胆道闭锁
疾病病因
(一)发病原因
病因尚无明确结论,早期认为该病为先天性胆管发育异常,与胚胎期第4~10周胆管系统发育停顿或紊乱有关。然而,对大量流产或早产儿胆道系统的解剖却并未发现过胆道闭锁,相反近年研究有更多证据支持此病为后天形成。部分病儿出生时有正常黄色大便,数周后才出现灰白色大便及黄疸,也提示这些病儿胆道梗阻出生后才发生。
 此外,病理检查发现肝脏组织呈炎症性变化,肝门及胆管周围有炎症细胞浸润,肝小叶发生微小脓灶或局限性坏死,胆管闭塞处肉芽组织形成。通过对肝外胆道闭锁和新生肝炎的对比病理研究,发现两者肝组织病变相似,仅程度不同。肝外胆道闭锁以胆管胆栓和炎症病变表现为主,而婴儿肝炎肝细胞坏死表现更突出。因此现在认为胆道闭锁可能是一种与婴儿肝炎病理过程相似的获得性疾病。
此外,病理检查发现肝脏组织呈炎症性变化,肝门及胆管周围有炎症细胞浸润,肝小叶发生微小脓灶或局限性坏死,胆管闭塞处肉芽组织形成。通过对肝外胆道闭锁和新生肝炎的对比病理研究,发现两者肝组织病变相似,仅程度不同。肝外胆道闭锁以胆管胆栓和炎症病变表现为主,而婴儿肝炎肝细胞坏死表现更突出。因此现在认为胆道闭锁可能是一种与婴儿肝炎病理过程相似的获得性疾病。
出生后所见的胆道闭锁是炎症过程的终末阶段和结局,炎症破坏致使胆管纤维瘢痕化并且闭塞。引起炎症的病因以病毒感染为主,如乙肝病毒、巨细胞病毒等,也可能是风疹病毒、甲型肝炎病毒或疱疹病毒。有学者提出胰胆管汇合部位异常也可能是胆道闭锁发生的先天性因素。
本病的病因虽多,但最终结果是胆汁排泄通路梗阻,出现阻塞性黄疸。近期研究表明,肝内、外胆道的发育为两个来源,从而可以解释胆道闭锁者胆囊以下管道可以通畅,而肝胆管以上管腔纤维化致闭锁的情况。
(二)发病机制
本病由于胆道阻塞,胆汁淤积,使肝实质受损。早期肝可轻度肿大,数个月后即可发展为严重胆汁性肝硬化,肝脏明显肿大,质地变硬,表现为褐绿色,呈细颗粒状或结节状。切面可见网络状灰白色结缔组织增生。显微镜下,肝小叶被增生的纤维组织条索分隔变形,大小不等,形状不一,中央静脉偏位或不清,肝细胞索排列紊乱,肝血窦扩张或变窄。肝细胞有胆汁沉着,呈均匀黄染、细颗粒状或粗颗粒状。
全部病例可见肝细胞空泡样变性、肝细胞肿胀、肝细胞增生和库普弗细胞动员象。肝内型病理改变在出生后2~3个月可表现为胆汁滞留、肝硬化,出生5~6个月,多数小叶间胆管破坏消失,小胆管排列不整齐,狭窄或闭锁,新生胆管明显减少,在汇管区域几乎见不到胆管。
肝外型胆管闭锁的肝内胆管开放,而肝外部分或完全闭锁。由于梗阻的部位和范围不同,胆道闭锁的病理改变也有差异。闭锁的胆道在组织学上符合炎症改变,有少许细胞浸润的结缔组织组成其内面覆盖肉芽组织,在肉芽组织中可见到很多圆形细胞浸润和吞噬胆色素的组织细胞,而具有内腔的胆总管见不到上述病理改变,组织学结构正常,其内衬以圆柱形上皮。有学者发现2/3以上的胆管闭锁病儿有巨肝细胞出现,与新生儿巨细胞肝炎相似,故认为这两种疾病有密切的关系。Hitch按肝组织结构的改变罗列了8项指标:
③汇管区炎症;
④胆液淤滞;
⑤纤维化;
⑥胆管增生;
⑦巨细胞转化;
后5项指标对于胆管闭锁和新生儿肝炎差异是显著的。电镜检查可见:肝细胞内可见较多的形态各异、大小不一、密度不均的高电子密度物质(electron dense material,EDM),Kupffer细胞质内亦可见有EDM。有些毛细胆管附近细胞膜连接破坏,使细胞间隙局限性不规则扩大。微绒毛未见异常。与胆道闭锁相比,新生儿肝炎患者肝组织内EDM较少,毛细胆管数量略少,管径稍小,未见破坏现象,微绒毛则较多。目前学者们对胆道闭锁电镜所见解析不一,有待进一步研究。
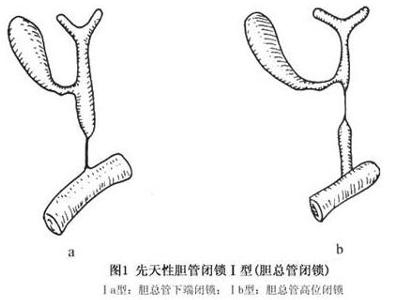
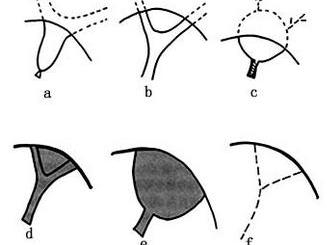
先天性胆道闭锁有多种分型方法,根据胆管闭锁的病变范围不同,目前常用的分型法将其分为以下各型。
Ⅱa型:胆囊至十二指肠间的胆管开放,而肝管完全缺损或呈纤维条索状。
Ⅲa型:肝管扩张型。
Ⅲb型:微细肝管型。
Ⅲd型:索状肝管型。
Ⅲf型:肝管缺如型。
 以往所谓的“不可吻合型”,其实在肝门区的胆管有各种表现。有时可见到大约1mm管径的胆管分支;有时胆管的纤维结缔组织条索与肝门部结缔组织团块和肝内肝纤维索相连。组织学发现几乎全部病例都有微细开放的胆管,这是做肝门肠吻合的解剖学基础,为不可治疗的患者带来了生存的希望。
以往所谓的“不可吻合型”,其实在肝门区的胆管有各种表现。有时可见到大约1mm管径的胆管分支;有时胆管的纤维结缔组织条索与肝门部结缔组织团块和肝内肝纤维索相连。组织学发现几乎全部病例都有微细开放的胆管,这是做肝门肠吻合的解剖学基础,为不可治疗的患者带来了生存的希望。
临床表现
胆道闭锁的典型病例婴儿为足月产,大多数并无异常,粪便色泽正常,黄疸一般在生后2-3周逐渐显露,有些病例的黄疸出现于生后最初几天当时误诊为生理性黄疸。粪便变成棕黄、淡黄米色,以后成为无胆汁的陶土样灰白色。但在病程较晚期时偶可略现淡黄色。尿色较深将尿布染成黄色。黄疸出现后,通常不消退且日益加深,皮肤变成金黄色甚至褐色,可因瘙痒而有抓痕有时可出现脂瘤性纤维瘤,但不常见。个别病例可发生杵状指或伴有发绀。肝脏肿大,质地坚硬脾脏在早期很少扪及,如在最初几周内扪及肿大的脾脏,可能是肝内原因随着疾病的发展而产生门静脉高压症。在疾病初期婴儿全身情况尚属良好,但有不同程度的营养不良,身长和体重不足时常母亲叙述婴儿显得兴奋和不安。疾病后期可出现各种脂溶性维生素缺乏现象,维生素D缺乏可伴发佝偻病串珠和阔大的骨骺。由于血液动力学状况的改变,部分动静脉短路和周围血管阻力降低在心前区和肺野可听到高排心脏杂音。
疾病并发
起初病婴吃奶正常精神尚好,以后则随肝硬化一系列症状的出现而出现食欲差,及出血倾向维生素A、D、EK缺乏症状、易感染、低血浆蛋白性水肿腹水等。未治的婴儿,1周岁前或因食道静脉曲张大出血死亡,或因肝昏迷或脓毒血症而夭折。
术后并发症常威胁生命最常见为术后胆管炎,发生率在50%,甚至高达100%其发病机理最可能是上行性感染,但败血症很少见。在发作时肝组织培养亦很少得到细菌生长有些学者认为这是肝门吻合的结果,阻塞了肝门淋巴外流,致使容易感染而发生肝内胆管炎不幸的是每次发作加重肝脏损害,因而加速胆汁性肝硬化的进程。术后第1年较易发生以后逐渐减少,每年4~5次至2~3次。应用氨基糖甙类抗生素10~14天可退热,胆流恢复,常在第1年内预防性联用抗生素和利胆药另一重要并发症是吻合部位的纤维组织增生,结果胆汁停止,再次手术恢复胆汁流通的希望是25%此外,肝内纤维化继续发展,结果是肝硬化有些病例进展为门脉高压、脾机能亢进和食管静脉曲张。
疾病诊断
渐进性黄疸,巩膜黄染是最早的体征。黄疸可出现在出生后不久或1个月内,亦有在生理性黄疸消退1~2周后,本应逐渐消退,反而呈进行性加重。随着黄疸的加重,粪便由正常黄色变淡以至白陶土色。有时由白陶土色又转为淡黄色,这是由于血液胆色素浓度过高胆色素通过肠壁渗入肠腔,使粪便着色。尿色加深,犹如浓茶色。
最初3个月患儿营养发育、身高和体重无明显变化。3个月后发育减缓,营养欠佳,精神萎靡,贫血。5~6个月后因胆道梗阻,脂肪吸收障碍,脂溶性维生素缺乏,全身状态迅速恶化。维生素A缺乏引起眼干、指甲畸形、皮肤干燥缺乏弹性;维生素D缺乏引起维生素D缺乏病、抽搐;维生素K缺乏,血清凝血酶减少,出现皮下淤血及鼻出血等现象;易合并上呼吸道感染及腹泻。
体检可见腹部膨胀,肝脏肿大,表面光滑,质地坚硬,边缘圆钝;晚期肝内淤胆,肝纤维变性,胆汁性肝硬化,可出现脾大、腹壁静脉曲张和腹水等门脉高压症状,最后导致肝功能衰竭,肝性脑病常是本病死亡的直接原因。如不能手术重建胆道,一般生存期为1年。
胆道闭锁的主要症状是持续性黄疸、陶土色粪便、浓茶样尿和肝脾肿大。晚期可表现为胆汁性肝硬化、腹水、腹壁静脉曲张和严重的凝血障碍,个别患儿由于肝内生成“血管舒张物质”,使肺循环与体循环短路开放,而出现发绀及杵状指。
胆管闭锁的早期诊断仍十分困难,所使用的诊断方法形式繁多,手段各异,均需结合临床及实验室检查进行综合分析,辅以核素检查、胆道造影及肝穿刺活检。对诊断困难者主张早期手术探查。
鉴别诊断
本病与下列疾病相鉴别:
 1.新生儿肝炎本病与新生儿肝炎鉴别最困难。有学者认为,胆道闭锁与新生儿肝炎可能为同一疾病的不同病理改变。约20%的新生儿肝炎有胆道完全性阻塞阶段,梗阻性黄疸的表现,极似胆道闭锁,但此类患儿肝外胆道大部分正常,很少见脾大。经一般治疗,多数4~5个月后,胆道疏通,黄疸逐渐消退,可自然痊愈。所以通过长时间的临床观察,可作出鉴别诊断,是先天性胆道闭锁若能在2个月内行胆道重建手术,可获得良好的胆汁引流效果;超过3个月肝脏由于胆汁性肝硬化已造成了不可逆的损伤,即使手术,效果也不佳,因此早期鉴别诊断十分重要。
1.新生儿肝炎本病与新生儿肝炎鉴别最困难。有学者认为,胆道闭锁与新生儿肝炎可能为同一疾病的不同病理改变。约20%的新生儿肝炎有胆道完全性阻塞阶段,梗阻性黄疸的表现,极似胆道闭锁,但此类患儿肝外胆道大部分正常,很少见脾大。经一般治疗,多数4~5个月后,胆道疏通,黄疸逐渐消退,可自然痊愈。所以通过长时间的临床观察,可作出鉴别诊断,是先天性胆道闭锁若能在2个月内行胆道重建手术,可获得良好的胆汁引流效果;超过3个月肝脏由于胆汁性肝硬化已造成了不可逆的损伤,即使手术,效果也不佳,因此早期鉴别诊断十分重要。
(1)临床鉴别要点:肝炎男婴多于女婴,而胆道闭锁女婴多于男婴;肝炎黄疸较轻有波动,胆道闭锁时黄疸持续性加重;肝炎时为黄色软便,胆道闭锁陶土色便出现较早且持续时间较长;胆道闭锁时肝大较肝炎重,质地硬,常伴有脾大。
(2)实验室鉴别:
①血清胆红素:肝炎患儿随病程而逐渐下降,胆道闭锁呈持续升高。
②碱性磷酸酶:新生儿肝炎很少超过40U,随肝炎好转而下降;胆道闭锁持续性升高。
③血清亮酸转肽酶的活化:新生儿肝炎只有23%的病例超过500U。
④血清5’-核苷酸酶的测定;胆道闭锁此酶浓度增高;新生儿肝炎病儿一般不超过25U/L。
⑤血清胆酸测定:胆道闭锁较新生儿肝炎血清胆酸明显增高,动态观察更有意义。
⑥血清甲胎蛋白测定:新生儿肝炎时肝细胞增生,甲胎蛋白合成增加,浓度升高,若高峰大于40ng/dl可诊断为新生儿肝炎。胆道闭锁主要是胆管上皮增生,无肝细胞增生,故血清甲胎蛋白为阴性,甚少阳性,平均值较低,两者差异明显。
(3)辅助检查:
①测定十二指肠引流液中的胆红素:十二指肠液不含胆红素者中,90%为先天性胆道闭锁,有助于先天性胆道闭锁的早期诊断。
②131I-RB排泄试验和99mTc-PL扫描:正常时131I-RB静脉注射后,为肝脏多角细胞摄取并通过胆汁排泄到肠道,不被肠道吸收,胆道闭锁患儿玫瑰红滞留于肝内不进入肠道,因此测定粪便内131I的含量可了解胆道阻塞情况。一般按2UC/kg注入静脉72h后测定粪便内131I的含量,90%的胆道闭锁131I随粪便排泄量在5%以下,而新生儿肝炎患儿几乎都在10%以上。99mTc-PL扫描亦有助于胆道闭锁和新生儿肝炎的鉴别。
③肝脏穿刺活检:新生儿肝炎以肝实质细胞病变为主,而胆道闭锁则以胆管系统及门静脉区病变为主。虽然胆道闭锁和新生儿肝炎病理改变无特征性变化,只是严重程度有区别,但汇管区面积,单位面积内小叶内的胆栓和小叶间的胆栓在两病间存在明显的差别。
④B型超声:新生儿肝炎时肝内外胆管、胆总管、胆囊为正常图像,但胆道闭锁的肝外胆道不能探出,胆囊瘪小或不显影,肝大伴有脾大。
⑤经皮肝穿刺胆管造影(PTC):此项检查不仅能用于鉴定胆道闭锁和新生儿肝炎,而且胆道闭锁患儿在术前行PTC检查能了解肝内外胆道的病变,确定梗阻部位,以此可确定术式。
2.新生儿溶血症
此症早期与胆道闭锁相似,有黄疸、肝脾肿大等,但患儿有严重贫血表现,末梢血象大量核红细胞,随病儿长大,血象多自行恢复正常。
病因为葡萄糖醛酸基转移酶的活力受到母乳中某些物质的抑制,一般于出生后4~7天黄疸加重,2~3周最深,血胆红素可达15~25mg/dl,停乳后2~4天高胆红素血症迅速消退,本病临床上无肝脾肿大及灰白便。
本病为黄疸、腹部包块,灰白色粪便,但黄疸为间歇性,B超可探及液平肿块。
此外,肝外胆道附近的肿物或胆总管下端淋巴结肿大,可以压迫胆道引起梗阻性黄疸;先天性十二指肠闭锁、环状胰腺及先天性肥厚性幽门狭窄等亦可引起梗阻性黄疸,也应与感染性黄疸和酶代谢异常所致的黄疸相鉴别。
疾病治疗
手术前检查肝功能、凝血功能。注射维生素K1。一般用Kasai手术治疗。手术成功率与年龄有关,年龄越小,成功率越高,病人如超过三月大,通常这手术不会成功,要考虑换肝。另外与成功率有关的是肝硬化的程度。部分手术后病人持续肝硬化,也要考虑换肝。
疾病预防
胆道闭锁不接受外科治疗,仅1%生存至4岁。但接受手术也要作出很大的决心,对婴儿和家庭都具有深远的影响,早期发育延迟,第1年要反复住院,以后尚有再次手术等复杂问题。
接受手术无疑能延长生存,报告3年生存率为35~65%。长期生存的依据是:①生后10~12周之前手术;②肝门区有一大的胆管(>150μm);③术后3个月血胆红素浓度<8.8mg/dl。近年Kasai报道22年间施行手术221例,至今尚有92例生存,79例黄疸消失,10岁以上有26例,最年长者29岁,长期生存者中,2/3病例无临床问题,1/3病例有门脉高压、肝功能障碍。
缓解方法
1、Kasai手术
BA治疗需采用手术方法才能实现,通常采用Kasai手术恢复正常胆流,以期实现肝功能的改善,达到长期存活的目的。若该手术不能使患儿黄疸消退或术后发生胆汁性肝硬化,肝移植是唯一的治疗方法。
Kasai手术根据手术方式分为开放式和腹腔镜手术,开放式手术即传统的Kasai手术,在BA的手术治疗中已成为广泛应用的术式,而腹腔镜下的Kasai手术由于技术要求高,当前其应用主要集中在少数几个小儿外科中心。Esteves E于2002年首次采用腹腔镜Kasai术治疗BA患儿,随着腹腔镜技术的推广和应用,该技术逐步受到认可,但当前对腹腔镜Kasai手术的疗效还存在争议。腹腔镜手术与开放Kasai术相比,术后并发症较多,早期预后较差,认为应谨慎应用腹腔镜技术治疗BA.但多数研究认为BA腹腔镜手术安全、可行、有效,与开放手术相比在手术时间、术后肠功能恢复、住院时间、并发症及后续肝移植需要方面没有差异。与传统Kasai手术相比,腹腔镜手术除了特定优势(损伤小、术后恢复快)外,术中在不移动肝脏的情况下,可以较好的暴露肝门部,使肝门部的组织游离和吻合更确切,有利于术后恢复。腹腔镜手术由于医生操作技术的差异,会导致治疗效果的不同,这可能是引起腹腔镜治疗胆道闭锁疗效差异的重要原因之一。但腹腔镜手术创伤小,术后恢复快的优点已得到大多数学者的认同,对于其是否能提高胆道闭锁长期预后还有待进一步的临床观察和研究。
2、肝移植治疗
BA是小儿肝移植的常见指征,占所有小儿肝移植总量的50%以上。在过去20多年里,由于肝移植成功应用于BA患儿的治疗,导致小儿肝移植的需求量显著上升。由此导致以下肝移植技术的广泛应用:减体积肝移植、劈裂式肝移植和活体肝移植。研究发现,BA患儿肝移植术后生存率与手术年龄、既往Kasai手术史无相关性,劈裂式肝移植的移植物生存率最高,减体积肝移植的移植物总体生存率最低。
婴幼儿体重轻,所需供肝的体积小,必须是减体积的供肝包括劈离式尸体供肝和活体供肝。尸体供肝来源日益紧缺,活体肝移植更值得倡导。因为:
1)扩大了供体来源;
2)活体肝移植由于大多为择期手术,故供体、受体可作充分的准备,在患儿病情恶化前施行肝移植,降低受者在等待肝移植中的死亡率;
4)术前可以对供体行CT、MRI等各项检查,从而有助于按最佳比例选取容量,使移植肝与受体更为匹配,术前亦可通过各项检查了解血管等解剖因素,有利于血管重建;
饮食禁忌
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。

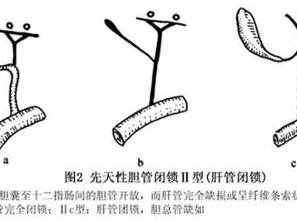 Ⅱ型:
Ⅱ型: