小儿先天性肾病综合征
分型
1、芬兰型:为常染色体隐性遗传,基因(CNF)定位于19q12-q13.1。多数为早产儿,胎盘巨大、重量超过25%体重,出生时或生后一月内出现水肿,伴腹水。有大量蛋白尿、低蛋白血症和高脂血症(早期不著)。预后差,多死于感染,对皮质激素治疗无效应,目前多采用早期一侧肾切除,2岁后行肾移植。也有报告长期服用依那普利(enalapril)降低蛋白尿。
2、弥漫性系膜硬化型:临床表现类似芬兰型,部分病例可在1岁后起病,起病时已有持续肾功能不全,在诊断后数月内死与慢性肾衰竭。诊断须靠病理检查。
病因
(一)发病原因
1.原发性: 包括芬兰型先天性肾病综合征,弥漫性系膜硬化,微小病变,局灶节段性硬化。
2.继发性: 可继发于感染(先天梅毒,先天性毒浆原虫病,先天性巨细胞包涵体病,风疹,肝炎,疟疾,艾滋病等),汞中毒,婴儿系统性红斑狼疮,溶血尿毒综合征,甲髌综合征,Drash综合征,肾静脉血栓形成等。
(二)发病机制
1.发病机制:已明确芬兰型先天性肾病综合征是一种常染色体隐性遗传性疾病,其基因定位于19号染色体长臂,发病机制渐渐得以阐明,1966年Norio对57个芬兰家系进行遗传调查,明确此征为常染色体隐性遗传性疾病,现知其缺陷基因定位于19号染色体长臂13.1,1983年Vernier等以阳离子探针PEI检测5例先天性肾病综合征,发现GBM的阴离子位点数量减少,该作者认为硫酸类肝素的减少是引起本征中肾小球滤过膜对蛋白通透性增高的原因,1998年Karl Tryggrason等报告本症有肾小球足突间的裂孔隔膜上nephrin的异常,为编码nephrin的基因NpHSI突变所致。
2.病理改变: 病理所见因病期早晚不一,在疾病的早期阶段,肾小球可能正常,也可能呈现局灶节段性硬化,系膜细胞及系膜基质增生;呈现弥漫性肾小管囊性扩张,在疾病的晚期阶段,肾小球毛细血管襻塌陷,呈现弥漫性硬化。肾小管广泛扩张,萎缩。间质炎症细胞浸润及纤维化,有人曾称本征中最具特色的改变是近曲小管囊性扩张,被称为“小囊性病”(microcystic disease),但发现肾小管的这一病变可能系获得性者,是由于持续的大量蛋白尿和(或)小管内尿流受阻,致未完全成熟的肾单位出现小管囊性改变,免疫荧光检查病早期无Ig和补体沉着,免疫电镜检查显示足突间裂孔隔膜上nephrin异常,电镜示内皮细胞肿胀,上皮细胞足突融合,基膜皱缩等。
症状
1.家族史和生产史 很大一部分CNS的患儿有阳性家族史,多数患儿为35~38周早产,体重偏低,常为臀位,常有宫内窒息史,Apgar评分偏低,羊水中有胎粪,本征特征是大胎盘,正常儿胎盘不超过胎儿体重的25%,而Huttenen的报告中胎盘占体重0.42,而正常对照为0.18,母亲妊期常合并妊娠中毒症,羊水AFP水平增高是患儿的特征性改变,由于在宫内排蛋白尿,在妊娠16~22周时,羊水的AFP水平增高。
2.临床特点
(1)特殊外貌:出生后常见特殊的外貌, 如鼻梁低,眼距宽,低位耳,颅缝宽,前囟和后囟宽大,还常见髋,膝,肘部呈屈曲畸形,其后常见腹胀,腹水,脐疝。
(2)水肿:半数于生后1~2周内即见水肿,也可迟至数月后始为家长发现。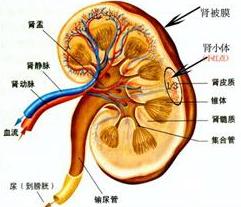
(3)蛋白尿:患儿蛋白尿明显且持续,最初为高度选择性蛋白尿,疾病后期则选择性下降,患儿并有明显的低白蛋白血症和高脂血症。
(4)生长发育落后:由于蛋白质营养不良,患儿常有生长发育落后,也有伴发胃食管反流和幽门狭窄的报告。
3.继发改变 由于持续的肾病状态,又常导致其他的病理生理变化,如:
(1)免疫力低下:由于尿中丢失Ig和补体系统的B因子,D因子致免疫力低下,发生多种继发感染(如肺炎,败血症,腹膜炎,脑膜炎,尿路感染等);感染是导致本征死亡的主要原因。
(2)发生血栓,栓塞:患儿常呈高凝状态,甚至发生血栓,栓塞合并症,Mahan等的病例中10%有此类合并症,可见于多处血管如外周动脉,矢状窦,肾,肺和其他静脉。
(3)其他:由于尿中丢失T4和甲状腺结合蛋白而甲状腺功能低下;丢失转铁蛋白而致缺铁性贫血;丢失维生素D结合蛋白而维生素D不足。
(4)肾功能减退:随年龄增长,肾功能逐渐缓慢减退,生后第2年GFR常<50ml/(min·1.73m2),并有相应的慢性肾功能减退的血生化改变,多数病儿3岁时已需透析或移植, 出生3个月内出现的肾病综合征为先天性肾病综合征。
并发症
检查
1.羊水AFP水平增高: 是CNS患儿的特征性改变,由于在宫内排蛋白尿,在妊娠16~22周时,羊水的AFP水平增高;先天性神经管发育不全,也可出现羊水AFP水平增高,但其胆碱酯酶水平常同时增高可资鉴别。
3.低蛋白血症 :CNS患儿血白蛋白水平很低,通常少于10g/L。
5.继发性CNS同时有原发疾病的实验室检查特点,如先天性梅毒,VDRL试验阳性,弓形虫,风疹,巨细胞,肝炎病毒感染,其抗体滴度升高等,汞中毒,弓形虫,风疹,巨细胞,肝炎病毒感染等,常呈现免疫复合物肾炎的病理改变特征。此外,在巨细胞感染的病人,内皮细胞中可见巨细胞包涵体存在。
6.光镜:在疾病的早期阶段,肾小球可能正常,也可能呈现局灶节段性硬化,系膜细胞及系膜基质增生;肾小管呈现囊性扩张,在疾病的晚期阶段,肾小球毛细血管襻塌陷,呈现弥漫性硬化;肾小管广泛扩张,萎缩。间质炎症细胞浸润及纤维化,在DMS的早期阶段仅有足突细胞的肥大,足突的融合,系膜基质的增殖;晚期阶段,大多数肾小球呈皱缩硬化的毛细血管襻沿着空泡变性的上皮细胞排列,小管萎缩,炎症细胞浸润,间质纤维化,先天性梅毒感染光镜常表现为膜性或增生性肾小球肾炎,偶尔也伴有新月体的形成,间质广泛的炎症细胞浸润。
7.免疫荧光 :早期正常;晚期在系膜区可有少量的IgM和C3沉积,先天性梅毒感染免疫荧光可发现在系膜沉积区域有梅毒螺旋体抗原存在。
8.其他: 应常规做影像学检查,如B超检查,X线检查等。
诊断鉴别
诊断
1.芬兰型
(1)临床诊断依赖于:①家族史;②宫内已有蛋白尿,于临床出现症状时,血中白蛋白多已<10g/L,当纠正血中白蛋白至15g/L时,尿中蛋白可>20g/L;③胎盘大(>出生体重的25%);④临床表现且6个月内GFR常仍系正常;⑤除外其他已知病因;⑥肾活体组织检查。
(2)产前诊断:产前诊断常借助于羊水中的甲胎蛋白,AFP是一种正常的胎儿期的蛋白,由胎儿肝,卵黄囊及消化道合成,其分子大小及电化学特性与血中白蛋白者相似,妊娠13周时胎儿血中浓度达到高峰,当胎儿发生蛋白尿时,则AFP随尿蛋白进 入羊水中,故对曾分娩过本病小儿的孕妇于再次妊娠11~18周时检测羊水的AFP可有助于产前诊断,但应注意此种蛋白之增高还可见于有神经管畸形的小儿, 但神经管畸形者除羊水中AFP增高外,胆碱酯酶也增高,可资鉴别,此外AFP还可见于双胎,Turner综合征等,近年由于对NpH-SI基因序列的研 究,已有望做出确切产前诊断。
2.非芬兰型:本病也是常染色体隐性遗传病,多在3个月~3岁的儿童中发病,偶尔也见于出生时或出生后3个月内,病理学特征是肾小球弥漫性系膜硬化或增生硬化,局灶节段性硬化,肾小管呈囊性扩张,以深皮质层最显著,临床上这些患儿绝大部分表现为肾病综合征,并较为迅速地进展为终末期肾病。
3.Drash综合征: Drash综合征表现为先天性肾病综合征,并发于Wilms瘤和(或)男性假两性畸形,其他相关的病变如白内障,角膜混浊,小头,斜视,眼球震颤及 眼距过宽等,该综合征在同胞中出现,对治疗无反应,且可在肾同种移植后再发,这些患者移植后肾病综合征的再发是因巨细胞病毒感染或移植排斥反应,尽管男性 假两性畸形46XY和眼异常是Drash综合征的常见伴随症状,但有报道在一例46XY女性病人中表现了该综合征,肾脏病理表现是弥漫性系膜硬化,由于双 侧Wilms瘤高发,因此,有人推荐做预防性肾切除。
4.Galloway-Mowat综合征和Roos综合征:Galloway-Mowat综合征也表现为先天性肾病综合征,典型的肾脏病理表现为,在结构扭曲的肾小球基底膜上,有絮状物及细纤维丝(6~8nm)沉 积,表现为小头,婴儿痉挛,精神运动性阻滞的Roos综合征,也是一种家族性疾病,它在婴儿期常伴发肾病综合征,Roos综合征的肾脏病理表现是局灶性节 段性肾小球硬化伴广泛系膜崩解,脊椎上皮发育不良,精神发育迟缓,传导性听力丧失和色素性视网膜炎,也是与婴儿期局灶性节段性肾小球硬化和肾病综合征有关的综合征。
5.继发性先天性肾病
(1)临床表现:继发性CNS除了肾病的临床表现外,还常伴有一些特有原发疾病的临床紊乱症状,可与原发性CNS相鉴别。
(2)实验室检查:继发性CNS除了与原发性CNS有着相似的实验室检查结果以外,还同时有一些原发疾病的实验室检查特点,如先天性梅毒病人,VDRL试验为阳性;如弓形虫,风疹,巨细胞,肝炎病毒感染,其抗体滴度升高。
(3)病理:随着病因的不同,继发性CNS在病理改变上常有它们各自的特点。
①先天性梅毒感染:光镜常表现为膜性或增生性肾小球肾炎,偶尔也伴有新月体的形成,间质广泛的炎症细胞浸润;免疫荧光可发现在系膜沉积区域有梅毒螺旋体抗原存在,电镜下可发现沿着基膜有小结节致密物在内皮下沉积。
②汞中毒,弓形虫,风疹,巨细胞,肝炎病毒感染:常呈现免疫复合物肾炎的病理改变特征;此外,在巨细胞感染的病人,内皮细胞中可见巨细胞包涵体存在。
鉴别诊断
应首先除外已知病因致成的继发性者,因原发病的治疗(如继发于梅毒的抗梅治疗)可望肾病缓解,结合引起继发性者的原发病本身其他临床和化验表现,多可明确诊断,小婴儿有不能解释的肾病综合征伴外生殖器异常,则应考虑到Drash综合征,此征Drash 1970年报告,表现为肾胚胎瘤(Wilm瘤),男性假两性畸形及肾脏受累(可表现为肾病综合征)。部分病例仅有二联表现,其肾脏病理表现为弥漫性肾小球系膜硬化(diffuse mesangial sclerosis)和肾小管萎缩,其病变于肾皮质表层的肾小球重于近髓质者,能引起原发性先天性肾病综合征者,除芬兰型先天性肾病综合征外尚可由弥漫性系膜硬化引起,此病围生期无异常,胎盘大小正常,起病虽也可早在新生儿期,但多在出生3个月以后。
本症较早进入肾功能减退,因尿毒症而死亡,病理上早期为系膜硬化,肾小球毛细血管襻塌陷,并无细胞增生;后期则肾小球硬化和肾小管,间质纤维化,此外偶见由微小病变,局灶节段性硬化病理改变引起者,其对肾上腺皮质激素治疗效应同年长儿,婴儿型肾病综合征(infantile nephrotic syndrome,INS)与CNS的起病均是发生在出生后第一年,但INS起病较CNS晚,常在第1年的后半年起病,尤其很少在出生后3个月内起病,目前认为主要是由于肾小球基底膜的完整性受到破坏,其通透性增加致大量蛋白尿滤出。
治疗与预后
自开展肾移植术以来本征预后已大为改观,有作者报告1987年后肾移植的34例随访3.7年,其移植肾存活率于1,2,3年时分别为94%、81%、81%;GFR于1,3年时分别为73.7%和75.3%。患儿情况较好,只1例发生慢性排异、高血压。主要是对症和支持治疗。
1.肾移植: 惟一彻底治疗是行肾移植,将健康者的肾脏移植给有肾脏病变并丧失肾脏功能的患者。开刀是治疗慢性肾功能衰竭的一项有效手段,肾移植因其供肾来源不同分为自体肾移植,同种肾切除移植,和异种肾移植。
通常于2岁后或体重达7kg时进行。对蛋白尿严重者可先行肾切除术(终止蛋白尿),靠透析维持生命等待移植。1992年Mattoo等报告行一侧肾切除术,减少尿蛋白排出,而另一肾维持肾功能,认为此法能减少每月人血白蛋白的输注。
2.减轻水肿 :对严重低白蛋白血症,或伴低血容量表现者可输注无盐白蛋白。芬兰有主张自生后4周即静脉输人血白蛋白,维持其血浆蛋白在15g/L以上,则此时一般可无水肿且生长发育接近正常。限盐、使用利尿剂。近年有报告伴用吲哚美辛(消炎痛),也有报告应用血管紧张素转换酶抑制剂(ACEI),可减轻其蛋白尿者。
3.防治感染:一旦发生感染应及时积极治疗,通常不预防性投用抗生素。必要时可间断地应用人血丙种球蛋白制剂。感染为主要死亡原因,应注意保护。
4.防治并发症: 一般病儿血压正常,后期血压增高者予以降压药。治疗继发性甲状腺功能低下,有高凝者给双嘧达莫(潘生丁)、小量阿司匹林。
预后
FNS对肾上腺皮质激素治疗反应差,常表现为对肾上腺皮质激素抵抗。大多数患儿在起病后1年内死亡,但很少因为肾衰竭,而是多死于严重的感染、营养 不良、腹泻、电解质紊乱等。继发性CNS随着其病因的不同而有着不同的预后,如感染所致者,采用强有力的抗感染治疗,病情常明显好转。
护理
预防
已明确此征为常染色体隐性遗传性疾病,应重视遗传病咨询和产前诊断,妊娠13周时胎儿血中甲胎蛋白浓度达到高峰,当胎儿发生蛋白尿时,则AFP随尿蛋白进入羊水中,故产前诊断常借助于羊水中的甲胎蛋白浓度检测,对曾分娩过本病小儿的孕妇于再次妊娠11~18周时,检测羊水的AFP可有助于产前诊断,近年由于对NpHSI基因序列的研究,已有望做出确切产前诊断,继发于各种感染者,应积极予以预防,加强防治卫生宣传,加强孕期保健和产前检查等等。
饮食保健
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。
上一篇 成骨不全症
下一篇 小儿假性甲状旁腺功能减低症