胰多肽瘤
病因
发病机制
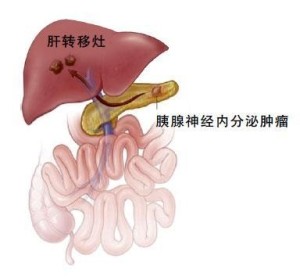
1972年由ChanceKimmel及Pollack分离出PP后对其生理作用已有一些报道PP于进餐后明显增高,持续可达6~8h,生物功能及进餐后增高的生理意义尚不太清楚,可能在于调节餐后酶,消化液分泌不致过分或分泌时间过长起一定程度的“制动”作用。尽管如此,对其生理作用目前了解不多,Greenberg等认为PP鶒在人类鶒的生理作用是抑制胆囊收缩,促进胰液分泌。PPoma多位于胰腺头部,位于体尾部者较少,少数病人肿瘤分布健康搜索在胰外器官。肿瘤多有完整的包膜,切面可能见到出血坏死及囊性变;瘤体常较大,直径多大于5cm;肿瘤常为单发。本病多数为恶性肿瘤,少部分为良性肿瘤或仅为PP细胞增生。恶性PPoma常见转移部位是肝脏但也可转移至肺、脑和骨骼。通过免疫组织化学方法,用多种胃肠激素抗血清作检查,可见PP的含量最高,其他胃肠激素为阴性或弱阳性。测定肿瘤组织中的PP,其含量极高,可达196.5μg/g湿组织,而其他胃肠激素含量甚微或阴性应用电子显微镜检查见肿瘤细胞内的颗粒形态与PP颗粒一致。
临床表现
PPoma的临床表现与过度分泌的PP无明显关系。大部分PPoma病例无明显症状。有些PPoma患者可表现为WDHA综合征的表现如腹泻(水泻或伴脂肪泻),或轻或重,个别病例可类似VIP瘤时的水泻、低血钾、低胃酸综合征样表现;通过对血清和瘤组织PP和VIP的测定血中PP升高1000多倍而VIP不高,因此认为PP亦可引起水泻及脂泻等表现。此外,由于PP细胞主要分布在胰头故PP瘤常以胰头增大为主,可压迫门脉胆系等而致相应临床症状,临床上可出现腹痛及腹块。
并发症
实验室检查
血清PP放免测定是诊断本病很重要的指标。本病患者空腹血清PP水平多为正常的20~50倍,有的甚至高达700倍以上。但随着PP放免测定的广泛开展,发现30%~70%的各种胰岛内分泌肿瘤均可伴有PP细胞增生,外周血PP浓度增高,故提示PP为胰岛内分泌肿瘤的肿瘤标记,或PP细胞似为胰岛内分泌细胞的更早期具干细胞性质的细胞。
辅助检查
定位诊断可依靠B超、CT、MRI和选择性血管造影等检查,有助于了解肿瘤的部位、大小、数目及有无转移。Glaser等提出可用经皮经肝门静脉采样(percutaneous transheptatic portal venour sampling)确定PP产生的部位,对肿瘤定位有帮助。
诊断
因PPoma无特殊症状,故诊断比较困难。诊断主要依据血中PP测定和免疫组织化学检查空腹血清PP明显增高的病例,健康搜索不论是否有临床症状,似均有剖腹探查健康搜索的指征,并且需作垂体、甲状腺、肾上腺等腺体的检查,以免漏诊多发性内分泌腺瘤病。Glaser等报告2例老年男性、有腹痛、呕吐,上腹扪及有肿瘤肿块,且伴肝脏转移,肿瘤组织及外周血中均有PP极度增高,而其他各种消化道激素均为正常范围的恶性PP癌的病例。此后也均有报告单纯只分泌PP的胰腺内分泌肿瘤。
鉴别诊断
治疗
由于PPoma通常无激素相关症状治疗主要是针对瘤块本身。因此外科手术是本病的首选治疗方法,即使发生转移,手术切除转移灶仍可使症状消失,生化指标恢复正常,甚至有可能治愈。对于不能切除的晚期肿瘤病人鶒,可使用链佐霉素化疗化学疗法可使症状缓解或部分缓解,血清PP下降甚至恢复正常。
预后
胰多肽瘤恶性趋势很大,即使无症状而血清胰多肽升高数年的病例,亦可发展为恶性瘤伴转移最后死亡。进展较缓慢,已有转移或行手术治疗的较晚期的病例,也能存活数年。文献记录12例本病患者,治疗前病程1月~7年,自开始治疗生存2~3年的患者也不乏其人。
预防护理
预防
本病暂无有效预防措施,早发现早诊断是本病防治的关键。少吃油腻过重的食物;少吃狗肉、羊肉等温补食物;少吃不带壳的海鲜、笋、芋等容易过敏的"发物";少吃含化学物质、防腐剂、添加剂的饮料和零食。忌食过酸、过辣、过咸、烟酒等刺激物。
护理
饮食应以清淡而富有营养为主。多吃蔬菜、(如卷心菜和菜花等)及萝卜、酸梅、黄豆、牛肉、蘑菇、芦笋、薏苡仁等、食物中含有抗癌物质,水果、牛奶、甲鱼等富含多种氨基酸、维生素、蛋白质和易消化的滋补食品。肿瘤病人热能消耗大,因此饮食要比正常人多增加20%的蛋白质。
饮食保健
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。

 因其
因其