帕金森病
疾病命名
 早在4000多年前就有人对帕金森病的症状进行描述,但直到1817年才由英国医师詹姆士·帕金森首先将它定为一种独立的疾病,该病最主要表现为肢体震颤(抖动)、运动迟缓(少动)。1814年马休·豪医师将此病命名为"震颤麻痹"。此后,法国神经病学家夏科等又补充了身体强直、姿势不稳等体征。后来,人们对该病进行了更为细致的观察,发现虽然有震颤,肌肉僵直、写字越写越小等症状,但是四肢肌肉的力量并没有受损,认为称麻痹并不合适,为了纪念最早报道该病的英国医生,将该病命名为“帕金森病”。
早在4000多年前就有人对帕金森病的症状进行描述,但直到1817年才由英国医师詹姆士·帕金森首先将它定为一种独立的疾病,该病最主要表现为肢体震颤(抖动)、运动迟缓(少动)。1814年马休·豪医师将此病命名为"震颤麻痹"。此后,法国神经病学家夏科等又补充了身体强直、姿势不稳等体征。后来,人们对该病进行了更为细致的观察,发现虽然有震颤,肌肉僵直、写字越写越小等症状,但是四肢肌肉的力量并没有受损,认为称麻痹并不合适,为了纪念最早报道该病的英国医生,将该病命名为“帕金森病”。
疾病分型
 按世界卫生组织(WHO)推荐的ICD-DA分类标准可将帕金森病分为5个类型:典型型、少动型、震颤型、姿势不稳步态障碍型以及半身型。但临床上根据帕金森病的临床表现主要分为混合型、震颤型、强直型3个类型:
按世界卫生组织(WHO)推荐的ICD-DA分类标准可将帕金森病分为5个类型:典型型、少动型、震颤型、姿势不稳步态障碍型以及半身型。但临床上根据帕金森病的临床表现主要分为混合型、震颤型、强直型3个类型:
混合型
混合型指同时有肢体震颤和肌肉强直的表现,即震颤-强直型或强直-震颤型,此型占帕金森病的大多数。
震颤型
强直型
发病机制
 帕金森病的病因尚未完全明确,还没有确切可靠的临床或检测手段来确定其病因。多数学者认为该病与年龄因素、环境因素和遗传因素之间的相互作用有关。
帕金森病的病因尚未完全明确,还没有确切可靠的临床或检测手段来确定其病因。多数学者认为该病与年龄因素、环境因素和遗传因素之间的相互作用有关。
遗传因素
20世纪90年代后期发现在意大利、希腊和德国的个别家族性帕金森病患者中存在α-突触核蛋白(α-synuclein,SNCA)基因突变,呈常染色体显性遗传,其表达产物是路易小体的主要成分。至少发现17个单基因(Park1~18)是家族性帕金森病连锁的基因点,其中12个致病基因已被克隆,即SNCA(PARK1,4q21-23)、Parkin(PARK2,6q25.2-27)、UCH-L1(PARK5,4p14)、PINK1(PARK6,1p35-36)、DJ-1(PARK7,1p36)、LRRK2(PARK8,12pl1.2-q13.1)、ATP13A2(PARK9,1p36)、HTRA2(PARK13,2p12)、PLA2G6(PARK14,22q13.1)、FBXO7(PARK15,22q12-13)、VPS35(PARK17,16q11.2)、EIF4G1(PARK18,3q27.1)基因。α-synuclein、LRRK2和UCHL-1基因突变呈常染色体显性遗传,Parkin、PINK1、DJ-1基因突变呈常染色体隐性遗传。ATP13A2、PLA2G6、FBXO7、SPG11也为早发型帕金森病的常染色体隐性遗传,但不常见。另有一些尚未被克隆的基因如PARK3、PARK10、PARK11、PARK12和PARK16等有待进一步研究。绝大多数上述基因突变未在散发性病例中发现,只有LRRK2基因突变见于少数(1.5%~6.1%)散发性帕金森病。全基因组关联研究(GWAS)筛选出SNCA、LRRK2、MAPT及HLA等与帕金森病有关的单核苷酸多态性(SNPs),可能是帕金森病发病的易感因素。约10%的患者有家族史,绝大多数患者为散发性。
环境因素
20世纪80年代初发现一种嗜神经毒1-甲基4-苯基1,2,3,6-四氢吡啶(MPTP)在人和灵长类动物中均可诱发典型的帕金森综合征,其临床、病理、生化及对多巴替代治疗的反应等特点均与人类帕金森病甚为相似。MPTP本身无神经毒作用,但在脑内 胶质细胞中经单胺氧化酶B(MAO-B)催化后转变为强毒性1-甲基-4-苯基-吡啶离子(MPP+),后者被多巴胺转运体(DAT)选择性地摄入黑质多巴胺能神经元内,抑制线粒体呼吸链复合物I活性,使ATP生成减少,并促进自由基产生和氧化应激反应,导致多巴胺能神经元变性、丢失。
 研究者们开展的大量有关环境因素的研究,还发现环境中与MPTP分子结构相类似的工业或农业毒素,如某些杀虫剂、除草剂、鱼藤酮、异喹啉类化合物等也可能是帕金森病的病因之一,并且通过类似的机制引起多巴胺能神经元变性死亡。体内物质包括多巴胺代谢会产生某些氧自由基,而体内的抗氧化功能(如还原型谷胱甘肽、谷胱甘肽过氧化物酶等)可以有效地清除这些物质。帕金森病患者的黑质中存在复合物I活性和还原型谷胱甘肽含量明显降低,以及过度氧化应激,提示抗氧化功能障碍及过度氧化应激可能与帕金森病的发病和病情进展有关。
研究者们开展的大量有关环境因素的研究,还发现环境中与MPTP分子结构相类似的工业或农业毒素,如某些杀虫剂、除草剂、鱼藤酮、异喹啉类化合物等也可能是帕金森病的病因之一,并且通过类似的机制引起多巴胺能神经元变性死亡。体内物质包括多巴胺代谢会产生某些氧自由基,而体内的抗氧化功能(如还原型谷胱甘肽、谷胱甘肽过氧化物酶等)可以有效地清除这些物质。帕金森病患者的黑质中存在复合物I活性和还原型谷胱甘肽含量明显降低,以及过度氧化应激,提示抗氧化功能障碍及过度氧化应激可能与帕金森病的发病和病情进展有关。
神经系统老化
帕金森病主要发生于中老年人,40岁前发病相对少见,提示神经系统老化与发病有关。有资料显示30岁以后,随年龄增长,黑质多巴胺能神经元始呈退行性变,多巴胺能神经元渐进性减少。尽管如此,但其程度并不足以导致发病,老年人群中患病者也只是少数,所以神经系统老化只是帕金森病的促发因素。
多因素交互作用
帕金森病并非单因素所致,而是多因素交互作用下发病。除基因突变导致少数患者发病外,基因易感性可使患病几率增加,但并不一定发病,只有在环境因素、神经系统老化等因素的共同作用下,通过氧化应激、蛋白酶体功能障碍、炎性/免疫反应、线粒体功能紊乱、钙稳态失衡、兴奋性毒性、细胞凋亡等机制导致黑质多巴胺能神经元大量变性、丢失,才会导致发病。
流行病学
 帕金森病全人群患病率约为0.3%。作为一种典型的老年慢性疾病,帕金森病在老年人群中患病率成倍增加,65岁以上老年人群患病率为1%~2%,85岁以上为3%~5%。具体到不同年龄点,其患病率分别为60岁0.25%、65岁0.5%、70岁1%、75岁1.5%、80岁2.5%、85岁3.5%~4.0%;而全年龄段发病率为每年8~18/10万、65岁以上年龄段每年50/10万、75岁以上年龄段为每年150/10万、85岁以上年龄段为每年400/10万。根据年龄累计发生率可知,60岁老年人在80岁时罹患帕金森病的风险约为2.5%。
帕金森病全人群患病率约为0.3%。作为一种典型的老年慢性疾病,帕金森病在老年人群中患病率成倍增加,65岁以上老年人群患病率为1%~2%,85岁以上为3%~5%。具体到不同年龄点,其患病率分别为60岁0.25%、65岁0.5%、70岁1%、75岁1.5%、80岁2.5%、85岁3.5%~4.0%;而全年龄段发病率为每年8~18/10万、65岁以上年龄段每年50/10万、75岁以上年龄段为每年150/10万、85岁以上年龄段为每年400/10万。根据年龄累计发生率可知,60岁老年人在80岁时罹患帕金森病的风险约为2.5%。
流行病学调查研究显示其中欧美国家60岁以上帕金森病患病率达到1%,80岁以上超过4%。中国65岁以上人群患病率为1.7%,与欧美国家相似。中国是世界上人口最多的国家,预计中国帕金森病患病人数将从2005年的199万人上升到2030年的500万人,几乎占全球帕金森病患病人数的一半。
病理生理学
基本病变
黑质多巴胺能神经元及其他含色素的神经元大量变性丢失,尤其是黑质致密区多巴胺能神经元丢失最严重,出现临床症状时丢失至少达50%以上。其他部位含色素的神经元,如蓝斑、脑干的中缝核、迷走神经背核等也有较明显的丢失。
残留神经元胞浆内出现嗜酸性包涵体,即路易小体(Lewybody),此系由细胞质蛋白所组成的玻璃样团块,α-突触核蛋白、泛素、热休克蛋白等是形成路易小体的重要成分。
德国学者Braak提出了帕金森病发病的六个病理分级,认为帕金森病的病理改变并非始于中脑黑质,而是先发于延髓,只是在中脑黑质多巴胺能神经元丢失明显时(即病理分级4期)才出现帕金森病典型的运动症状,随疾病进展,逐累及脑桥→中脑→新皮质。这对于进一步认识帕金森病的早期病理改变,寻找到该病的早期生物标志物,实现对疾病的早期诊断,乃至早期预警及有效的疾病修饰治疗具有重要的意义。
生化改变
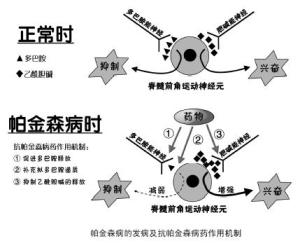 帕金森病最显著的生物化学特征是脑内多巴胺含量减少。纹状体中多巴胺与乙酰胆碱(ACh)两大递质系统的功能相互拮抗,两者之间的平衡对基底节运动功能起着重要调节作用。帕金森病中纹状体多巴胺水平显著降低,造成乙酰胆碱系统功能相对亢进,产生震颤、肌强直、运动减少等临床症状。
帕金森病最显著的生物化学特征是脑内多巴胺含量减少。纹状体中多巴胺与乙酰胆碱(ACh)两大递质系统的功能相互拮抗,两者之间的平衡对基底节运动功能起着重要调节作用。帕金森病中纹状体多巴胺水平显著降低,造成乙酰胆碱系统功能相对亢进,产生震颤、肌强直、运动减少等临床症状。
中脑-边缘系统和中脑-皮质系统的多巴胺水平的显著降低,可能导致认知功能减退、行为情感异常、言语错乱等高级神经活动障碍。多巴胺递质减少程度与患者症状严重度一致,病变早期通过多巴胺更新率增加(突触前代偿)和多巴胺受体失神经后超敏现象(突触后代偿),临床症状可能不明显(代偿期),随疾病的进展可出现典型帕金森病症状(失代偿期)。基底核其他递质或神经肽如去甲肾上腺素、5-羟色胺、P物质、脑啡肽、生长抑素等也有变化。
临床表现
帕金森病多隐匿起病,缓慢发展。主要表现有二大类症状,即运动症状和非运动症状。
运动症状
常始于一侧上肢,逐渐累及同侧下肢,再波及对侧上肢及下肢。
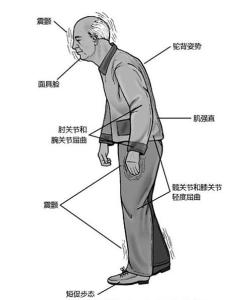
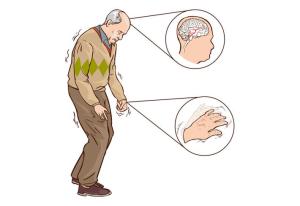
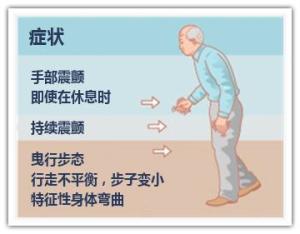 静止性震颤(statictremor)常为首发症状,多始于一侧上肢远端,静止位时出现或明显,随意运动时减轻或停止,紧张或激动时加剧,入睡后消失。典型表现是拇指与屈曲的食指间呈“搓丸样”(pill-rolling)动作,频率为4~6Hz。令患者一侧肢体运动如握拳或松拳,可使另一侧肢体震颤更明显,该试验有助于发现早期轻微震颤。少数患者可不出现震颤,部分患者可合并轻度姿势性震颤(posturaltremor)。
静止性震颤(statictremor)常为首发症状,多始于一侧上肢远端,静止位时出现或明显,随意运动时减轻或停止,紧张或激动时加剧,入睡后消失。典型表现是拇指与屈曲的食指间呈“搓丸样”(pill-rolling)动作,频率为4~6Hz。令患者一侧肢体运动如握拳或松拳,可使另一侧肢体震颤更明显,该试验有助于发现早期轻微震颤。少数患者可不出现震颤,部分患者可合并轻度姿势性震颤(posturaltremor)。
肌强直
肌强直(rigidity)被动运动关节时阻力增高,且呈一致性,类似弯曲软铅管的感觉,故称“铅管样强直”(lead-pipe rigidity);在有静止性震颤的患者中可感到在均匀的阻力中出现断续停顿,如同转动齿轮感,称为“齿轮样强直”(cogwheelrigidity)。四肢、躯干、颈部肌强直可使患者出现特殊的屈曲体姿,表现为头部前倾,躯干俯屈,肘关节屈曲,腕关节伸直,前臂内收,髋及膝关节略为弯曲。
运动迟缓
 运动迟缓(bradykinesia)随意运动减少,动作缓慢、笨拙。早期以手指精细动作如解或扣纽扣、系鞋带等动作缓慢,逐渐发展成全面性随意运动减少、迟钝,晚期因合并肌张力增高致起床、翻身均有困难。体检见面容呆板,双眼凝视,瞬目减少,酷似"面具脸"(maskedface);口、咽、腭肌运动迟缓时,表现语速变慢,语音低调;书写字体越写越小,呈现"小字征"(micro-graphia);做快速重复性动作如拇、食指对指时表现运动速度缓慢和幅度减小。
运动迟缓(bradykinesia)随意运动减少,动作缓慢、笨拙。早期以手指精细动作如解或扣纽扣、系鞋带等动作缓慢,逐渐发展成全面性随意运动减少、迟钝,晚期因合并肌张力增高致起床、翻身均有困难。体检见面容呆板,双眼凝视,瞬目减少,酷似"面具脸"(maskedface);口、咽、腭肌运动迟缓时,表现语速变慢,语音低调;书写字体越写越小,呈现"小字征"(micro-graphia);做快速重复性动作如拇、食指对指时表现运动速度缓慢和幅度减小。
姿势平衡障碍
姿势平衡障碍(posturalinstability)在疾病早期,表现为走路时患侧上肢摆臂幅度减小或消失,下肢拖曳。随病情进展,步伐逐渐变小变慢,启动、转弯时步态障碍尤为明显,自坐位、卧位起立时困难。有时行走中全身僵住,不能动弹,称为“冻结”(freezing)现象。有时迈步后,以极小的步伐越走越快,不能及时止步,称为前冲步态(propulsion)或慌张步态(festina-tion)。
非运动症状
 也是常见和重要的临床征象,可以发生于运动症状出现之前、甚至多年或之后。
也是常见和重要的临床征象,可以发生于运动症状出现之前、甚至多年或之后。
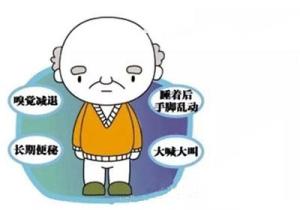
感觉障碍早期即可出现嗅觉减退(hyposmia),中晚期常有肢体麻木、疼痛。[1]
睡眠障碍尤其是快速眼动期睡眠行为障碍(rapideyemovementsleepbehaviordisorder,RBD)。有些患者可伴有不宁腿综合征(restlesslegsyndrome,RLS)。
自主神经功能障碍临床常见,如便秘、多汗、溢脂性皮炎(油脂面)等。吞咽活动减少可导致流涎。疾病后期也可出现性功能减退、排尿障碍或体位性低血压。
精神障碍近半数患者伴有抑郁,并常伴有焦虑。约15%~30%的患者在疾病晚期发生认知障碍乃至痴呆,以及幻觉,其中视幻觉为多见。
运动并发症
 运动并发症常见类型如下:
运动并发症常见类型如下:
剂末现象和开-关现象 在运动症状波动方面最常见的是剂末现象,即一种通过可以预见的运动或非运动症状的再发,出现于下次预定给药之前,给予帕金森药物通常可以改善,药物的疗效逐渐减退,每次服药后药效维持时间较以往缩短。随着帕金森病的进展逐渐出现不可预测的“开-关现象”(患者突然多动不安,而后又出现肌强直运动不能),症状在“开期”和“关期”之间波动,关期变得突如其来,不可预测。
异动症 又称运动障碍,绝大部分服用左旋多巴的患者会发生异动症。主要可累头部,颈部及肢体,表现为不自主粗大的舞蹈样或肌张力障碍样动作。常见的类型有:剂峰异动症(多发生在用药后1~2小时);清晨足部肌张力障碍(主要见于晨醒,表现为足部痉挛);双相性异动症(在转为“开”状态时出现异常不自主运动,然后疗效出现,在转为“关”状态时再次出现异常不自主运动。
检查诊断
诊断原则
主要是依据中老年发病,缓慢进展性病程,必备运动迟缓及至少具备静止性震颤、肌强直或姿势平衡障碍中的一项,偏侧起病,对左旋多巴治疗敏感即可作出临床诊断。
检查项目
体格检查
由于缺乏客观的能明确诊断的辅助检查手段,体格检查就显得尤为重要。应进行详细的神经系统检查,除了确定帕金森病的运动症状特征外,应注意有无提示继发性及帕金森叠加综合征的体征,如共济失调、眼球运动障碍、皮层复合感觉、语言能力、运用能力、卧立位血压及后拉试验等。后拉试验,即令患者睁眼直立,两腿略分开,做好准备,检查者用双手突然向后拉患者双肩,正常人能马上恢复直立位,有平衡障碍的帕金森病患者出现明显的后倾,轻者可自行恢复,后退2步及2步以内视为正常,3步及3步以上及可能摔倒者或站立时不能维持平衡,即为阳性。
实验室检查
常规检查:应检查血、尿、便常规,血生化(肝肾功能、血脂、血糖),甲状腺功能等。血、脑脊液常规检查均无异常,脑脊液中的高香草酸(HVA)含量可以降低。
影像学检查
CT、MRI检查无特征性改变,PET或SPECT检查有重要的辅助诊断价值。氟-多巴PET显像可显示多巴胺递质合成明显减少;I-β-CIT或mTc-TRODAT-I PET/SPECT显像可显示多巴胺转运体(DAT)功能显著降低,在疾病早期甚至亚临床期即显示降低;I-IBZMPET显像可显示D₂多巴胺受体功能在早期为失神经超敏,后期为低敏。这对早期诊断、鉴别诊断及监测病情有一定价值,但非临床诊断所必需和常用。
其他
嗅棒测试可发现早期患者的嗅觉减退。经颅超声(transcranialsonography,TCS)可通过耳前的听骨窗探测黑质回声,可以发现大多数PD患者的黑质回声增强。心脏间碘苯甲胍(metaiodobenzylguanidine,MIBG)闪烁照相术可显示心脏交感神经元的功能,早期PD患者的总MIBG摄取量减少。采用DNA印记技术、聚合酶链反应(PCR)、DNA序列分析、全基因组扫描等可能发现基因突变。
诊断指标
其诊断标准如下:
诊断标准 | 支持标准(必须具备下列3项或3项以上特征) | 排除标准 |
1.运动减少:启动随意运动的速度缓慢。疾病进展后,重复性动作的运动速度及幅度均降低 | 1.单侧起病 3.逐渐进展 4.发病后多为持续性的不对称性受累 5.对左旋多巴的治疗反应良好(70%~100%) 6.左旋多巴导致的严重的异动症 7.左旋多巴的治疗效果持续5年或5年以上 8.临床病程10年或10年以上 |
2.反复的脑损伤史 5.1个以上的亲属患病 7.接触已知的神经毒类 8.病情持续缓解或发展迅速 10.发病3年后,仍是严格的单侧受累 11.出现其他神经系统症状和体征,如垂直凝视麻痹、共济失调,早期即有严重的自主神经受累,早期即有严重的痴呆,伴有记忆力、言语和执行功能障碍,锥体束征阳性等 |
鉴别诊断
继发性帕金森综合征
共同特点是都有明确的病因,如感染、药物、中毒、脑动脉硬化、外伤等,相关的病史结合不同疾病的临床特征是鉴别诊断的关键。继发于甲型脑炎(即昏睡性脑炎)后的帕金森综合征,目前已罕见。多种药物均可引起药物性帕金森综合征,一般是可逆的。拳击手中偶见头部外伤引起的帕金森综合征。老年人基底节区多发性腔隙性梗死可引起血管性帕金森综合征,患者有高血压、动脉硬化及卒中史,步态障碍较明显,震颤少见,常伴锥体束征。
不少神经变性疾病具有帕金森综合征表现。这些神经变性疾病各有其特点,有些有遗传性,有些为散发性,除程度不一的帕金森症表现外,还有其他征象,如不自主运动、垂直性眼球凝视障碍(见于进行性核上性麻痹)、直立性低血压 (Shy-Drager综合征)、小脑性共济失调(橄榄体脑桥小脑萎缩)、早期先有且严重的痴呆和视幻觉(路易小体痴呆)、角膜色素环(肝豆状核变性)、皮质复合感觉缺失和锥体束征(皮质基底节变性)等。另外,这些疾病所伴发的帕金森症状,常以强直、少动为主,静止性震颤很少见,都以双侧起病(除皮质基底节变性外),对左旋多巴治疗不敏感。
其他
帕金森病早期患者尚需鉴别下列疾病:临床较常见的原发性震颤,1/3有家族史,各年龄段均可发病,姿势性或动作性震颤为唯一表现,无肌强直和运动迟缓,饮酒或用普萘洛尔后震颤可显著减轻。抑郁症可伴有表情贫乏、言语单调、随意运动减少,但无肌强直和震颤,抗抑郁剂治疗有效。早期帕金森病症状限于一侧肢体,患者常主诉一侧肢体无力或不灵活,若无震颤,易误诊为脑血管病或颈椎病,仔细体检易于鉴别。
治疗方法
治疗原则
综合治疗
每一位帕金森病患者可以先后或同时表现有运动症状和非运动症状,但在整个病程中都会有这两类症状,有时会产生多种非运动症状。不仅运动症状会影响患者的工作能力和日常生活能力,非运动症状也会明显干扰患者的生活质量。因此,应对帕金森病的运动症状和非运动症状采取全面综合治疗。
多学科治疗模式
帕金森病治疗方法和手段包括药物治疗、手术治疗、肉毒毒素治疗、运动疗法、心理干预、照料护理等。药物治疗作为首选,且是整个治疗过程中的主要治疗手段,手术治疗则是药物治疗不佳时的一种有效补充手段,肉毒毒素注射是治疗局部痉孪和肌张力障碍的有效方法,运动与康复治疗、心理干预与照料护理则适用于帕金森病治疗全程。因此,在临床条件允许的情况下,组建以神经内科、功能神经外科、神经心理、康复乃至社区全科医生等多学科团队的医生,可以更有效地治疗和管理帕金森病患者,更好地为患者的症状改善和生活质量提高带来更大的益处。
全程管理
应用的治疗手段,无论药物或手术,只能改善症状,不能阻止病情的发展,更无法治愈。因此,治疗不仅立足当前,而且需长期管理,以达到长期获益。
用药原则
疾病的运动症状和非运动症状都会影响患者的工作和日常生活能力,因此用药的原则以达到有效改善症状、避免或降低不良反应、提高工作能力和生活质量为目标。提倡早期诊断、早期治疗,不仅可以更好地改善症状,而且可能达到延缓疾病的进展。应坚持“剂量滴定”以避免产生药物急性不良反应,力求实现“尽可能以小剂量达到满意临床效果”的用药原则,可避免或降低运动并发症尤其是异动症的发生率。治疗应遵循循证医学证据,也应强调个体化特点,不同患者的用药选择需要综合考虑患者的疾病特点(是以震颤为主,还是以强直少动为主)和疾病严重度、发病年龄、就业状况、有无认知障碍、有无共病、药物可能的不良反应、患者的意愿、经济承受能力等因素。尽可能避免、推迟或减少药物的不良反应和运动并发症。抗帕金森病药物治疗时不能突然停药,特别是使用左旋多巴及大剂量多巴胺受体激动剂时,以免发生撤药恶性综合征。
药物治疗
早期帕金森病的药物治疗
根据临床症状严重度的不同,将Hochn-Yahr分级1.0~2.5级定义为早期。疾病一旦发生将随时间推移而渐进性加重,有证据提示在疾病早期阶段的病程进展较后期阶段进展快。因此一旦早期诊断,即应开始早期治疗,争取掌握疾病修饰时机,对于疾病治疗的长程管理有重要作用。早期治疗可以分为非药物治疗(包括认识和了解疾病,补充营养、加强运动康复、坚定战胜疾病的信心,以及社会和家人对患者的理解、关心与支持)和药物治疗。一般开始多以单药治疗,但也可采用两种不同作用机制(针对多靶点)的药物小剂量联合应用,力求疗效最佳,维持时间更长,而急性不良反应和运动并发症发生率更低。
早期帕金森病的疾病修饰疗法
疾病修饰治疗药物除有可能的疾病修饰作用外,也具有改善症状的作用;症状性治疗药物除能够明显改善症状外,其中部分也可能兼有一定的疾病修饰作用。疾病修饰治疗的目的是既能延缓疾病的进展,又能改善患者的症状。目前临床上尚缺乏具有循证医学证据的疾病修饰作用的药物,可能有疾病修饰作用的药物主要包括单胺氧化酶B型抑制剂和多巴胺受体激动剂。MAO-BI中的雷沙吉兰和司来吉兰可能具有疾病修饰的作用;REAL-PET研究提示DAs中的罗匹尼罗可能有疾病修饰作用。非药物运动疗法证据不足,待进一步研究。
临床上有多种可以有效改善帕金森病的药物。每一类药物都有各自的优势和劣势,在临床选择药物时应充分考虑到以患者为中心,根据患者的个人情况,如年龄、症状表现、疾病严重程度、共患病、工作和生活环境等进行药物选择和调整。
复方左旋多巴(多巴丝肼、卡比双多巴):左旋多巴是治疗帕金森病的标准疗法,是帕金森病药物治疗中最有效的对症治疗药物。然而,在大多数患者中,随着疾病进展和左旋多巴长期使用会产生运动并发症,包括症状波动和异动症。需要指出的是,现有证据提示早期应用小剂量左旋多巴400mg/d以内并不增加异动症的产生;与左旋多巴的治疗时间相比,高剂量的左旋多巴和长病程对异动症的发生风险影响更大。因此,早期并不建议刻意推迟使用左旋多巴,特别对于晚发型帕金森病患者或者运动功能改善需求高的较年轻患者,复方左旋多巴可以作为首选,但应维持满足症状控制前提下尽可能低的有效剂量。复方左旋多巴常释剂具有起效快之特点,而缓释片具有维持时间相对长,但起效慢、生物利用度低,在使用时,尤其是两种不同剂型转换时需加以注意。
多巴胺受体激动剂:有两种类型:麦角类DAs和非麦角类DAs,其中麦角类由于可能引起瓣膜病变的严重不良反应,临床已不主张使用,而主要推崇采用非麦角类,并作为早发型患者病程初期的首选药物,包括普拉克索(pramipexole)、罗匹尼罗(ropinirole)、吡贝地尔(piribedil)、罗替高汀rotigotine)和阿扑吗啡(apomorphine)。需要指出的是多巴胺受体激动剂大多有嗜睡和精神不良反应发生的风险,需从小剂量滴定逐渐递增剂量。在疾病早期左旋多巴和多巴胺受体激动剂均小剂量联合使用,充分利用两种药物的协同效应和延迟剂量依赖性不良反应,临床上现很常用3.2,早期添加DAs可能推迟异动症的发生。上述5种非麦角类药物之间的剂量转换为:普拉克索:罗匹尼罗:罗替高汀:吡贝地尔:阿扑吗啡=1:5:3.3:100:10,因个体差异仅作参考。
MAO-BI:包括第一代MAO-BI司来吉兰常释片和口崩片及第二代MAO-BI雷沙吉兰,以及中国尚未上市的双通道阻滞剂沙芬酰胺、唑尼沙胺。对于帕金森病患者的运动症状有改善作用,同时在所有抗帕金森病药物中可能相对有疾病修饰作用的证据,主要推荐用于治疗早期帕金森病患者,特别是早发型或者初治的帕金森病患者,也可用于进展期的帕金森病患者的添加治疗。在改善运动并发症方面,雷沙吉兰相对于司来吉兰证据更充分。使用司来吉兰时勿在傍晚或晚上应用,以免引起失眠。
儿茶酚-0-甲基转移酶抑制剂(catechol.O-methyliransferaseinhibitor,COMTI):主要有恩他卡朋(entacapone)、托卡朋(tolcapone)和奥匹卡朋(opicapone)以及与复方左旋多巴组合的恩他卡朋双多巴片(为恩他卡朋/左旋多巴/卡比多巴复合制剂,按左旋多巴剂量不同分成4种剂型)。在疾病早期首选恩他卡朋双多巴片治疗可以改善症状,但是否能预防或延迟运动并发症的发生,目前尚存争议,在疾病中晚期添加COMTI治疗可以进一步改善症状。需指出的是恩他卡朋须与复方左旋多巴同服,单用无效,托卡朋每日首剂与复方左旋多巴同服,此后可以单用,一般每间隔6h服用,但需严密监测肝功能。
抗胆碱能药:中国有苯海索(benzhexol),主要适用于有震颤的患者,而对无震颤的患者不推荐应用。对60岁以下的患者,需告知长期应用可能会导致认知功能下降,所以要定期筛查认知功能,一旦发现认知功能下降则应停用;对60岁以上的患者尽可能不用或少用;若必须应用则应控制剂量。
金刚烷胺:有两种剂型:常释片和缓释片,中国仅有前者,对少动、强直、震颤均有改善作用,对改善异动症有循证:有效,临床有用。
中晚期帕金森病的药物治疗
根据临床症状严重度的不同,将Hochn-Yahr分级3~5级定义为中晚期帕金森病,尤其是晚期帕金森病的临床表现极其复杂,其中有疾病本身的进展,也有药物不良反应或运动并发症的因素参与对中晚期帕金森病患者的治疗,既要继续力求改善运动状,又要妥善处理一些运动并发症和非运动症状。
运动症状及姿势平衡障碍的治疗
疾病进入中晚期阶段,运动症状进一步加重,行动迟缓更加严重,日常生活能力明显降低,出现姿势平衡障碍、冻结步态,容易跌倒。力求改善上述症状则需增加在用药物的剂量或添加尚未使用的不同作用机制的抗帕金森病药物,可以根据临床症状学(震颤还是强直少动为突出),以及对在用多种药物中哪一药物剂量相对偏低或治疗反应相对更敏感的药物而增加剂量或添加药物。冻结步态是帕金森病患者摔跤的最常见原因,易在变换体位如起身、开步和转身时发生,目前尚缺乏有效的治疗措施,调整药物剂量或添加药物偶尔奏效,部分患者对增加复方左旋多巴剂量或添加MAO-BI和金刚烷胺可能奏效。此外,适应性运动康复、暗示治疗,例如:步态和平衡训练、主动调整身体重心、踏步走、大步走、视觉提示(地面线条,规则图案 或激光束)、听口令、听音乐或拍拍子行走或跨越物体(真实的或假想的)等可能有益。必要时使用助行器甚至轮椅,做好防护。随着人工智能技术的发展,智能穿戴设备以及虚拟现实技术在改善姿势平衡障碍、冻结步态方面带来益处。
运动并发症的治疗
运动并发症(症状波动和异动症)是帕金森病中晚期阶段的常见症状,严重影响患者的生活质量,给临床治疗带来较棘手的难题。通过提供持续性多巴胺能刺激(continuousdopaminergicstimulation,CDS)的药物或手段可以对运动并发症起到延缓和治疗的作用”),调整服药次数、剂量或添加药物可能改善症状,以及手术治疗如脑深部电刺激(deepbrainstimulation,DBS)亦有效。
症状波动的治疗 症状波动主要有剂末恶化(endofdosedeterioration)、开-关现象(on-offphenomenon)等。对剂末恶化的处理方法有:(1)避免饮食(含蛋白质)对左旋多巴吸收及通过血脑屏障的影响,需在餐前1h或餐后1.5h服用复方左旋多巴,调整蛋白饮食可能有效“。(2)不增加服用复方左旋多巴的每日总剂量,而适当增加每日服药次数,减少每次服药剂量(以仍能有效改善运动症状为前提)。(3)复方左旋多巴由常释剂换用缓释片以延长作用时间,更适宜在早期出现的剂末恶化,尤其发生在夜间时为较佳选择,但剂量需增加20%~30%。(4)加用对纹状体产生续性多巴胺能刺激的长半衰期DAs。若已用DAs中的一种而出现不良反应或疗效减退可试换用另一种。另外,2017年NICE指南指出DAs在减少“关”期时间相对于MAO-BI和COMTI更多,但是幻觉的风险相对更高。(5)加用对纹状体产生续性多巴胺能刺激的COMTI。(6)加用MAO-BI(美国指南中雷沙吉兰为A级证据,司来吉兰为C级证据。(7)手术治疗主要为丘脑底核(STN)行DBS可获裨益,为C级证据。
对开-关现象的处理较为困难,可以选用口服DR激动剂,或可采用微泵持续输注左旋多巴甲酯、乙酯或DR激动剂(如麦角乙脲等)。
异动症的治疗 异动症包括剂峰异动症(peak-dosedyskinesia)、双相异动症(biphasicdyskinesia)和肌张力障碍(dystonia)。
对剂峰异动症的处理方法为:(1)减少每次复方左旋多巴的剂量,若伴有剂末现象可增加每日次数。(2)若患者是单用复方左旋多巴,可适当减少剂量,同时加用DAs,或加用COMTI。(3)加用金刚烷胺或金刚烷胺缓释片,后一剂型是唯一获批用于治疗左旋多巴相关的异动症口服药物。(4)加用非经典型抗精神病药如氯氮平。(5)若在使用复方左旋多巴缓释片,则应换用常释剂,避免缓释片的累积效应。
对双相异动症(包括剂初异动症和剂末异动症)的处理方法为:(1)若在使用复方左旋多巴缓释片应换用常释剂,最好换用水溶剂,可以有效缓解剂初异动症。(2)加用长半衰期的DAs或加用延长左旋多巴血浆清除半衰期、增加曲线下面的COMTI,可以缓解剂末异动症,也可能有助于改善剂初异动症。但是MDS循证提示普拉克索被评估为证据不足,待进一步研究。
肌张力障碍包括清晨肌张力障碍、关期肌张力障碍和开期肌张力障碍。对清晨肌张力障碍的处理方法为:(1)睡前加用复方左旋多巴缓释片或DAs。(2)也可在起床前服用复方左旋多巴水溶剂或常释剂。对“开”期肌张力障碍的处理方法同剂峰异动症。手术治疗方式主要为DBS,可获裨益。
非运动症状的治疗
帕金森病的非运动症状涉及许多类型,主要包括睡眠障碍、感觉障碍、自主神经功能障碍和精神及认知障碍。非运动症状在整个帕金森病的各个阶段都可能出现,某些非运动症状,如嗅觉减退、快速眼球运动期睡眠行为异常(rapideyemovementsleepbehaviordisorder,RBD)、便秘和抑郁可以比运动症状出现得更早。非运动症状也可以随着运动波动而波动(non-motorfluctuations)。非运动症状严重影响患者的生活质量,因此在管理帕金森病患者的运动症状的同时也需要管理患者的非运动症状。
睡眠障碍的治疗
60%~90%的患者伴有睡眠障碍,睡眠障碍是最常见的非运动症状,也是常见的帕金森病夜间症状之一。睡眠障碍主要包括失眠、RBD、白天过度嗜睡(excessivedaytimesleepiness,EDS)和不宁腿综合征(restlesslegssyndrome,RLS);其中约50%或以上的患者伴有RBD,伴RBD患者的处理首先是防护,发作频繁可在睡前给予氯硝西泮或褪黑素,氯硝西泮有增加跌倒的风险,一般不作为首选。
失眠和睡眠片段化是最常见的睡眠障碍,首先要排除可能影响夜间睡眠的抗帕金森病药物,如司来吉兰和金刚烷胺都可能导致失眠,尤其在傍晚服用者,首先需纠正服药时间,司来吉兰需在早、中午服用,金刚烷胺需在下午4时前服用,若无改善,则需减量甚至停药。若与药物无关则多数与帕金森病夜间运动症状有关,也可能是原发性疾病所致。若与患者的夜间运动症状有关,主要是多巴胺能药物的夜间血药浓度过低,因此加用DAs(尤其是缓释片)、复方左旋多巴缓释片、COMTI能够改善患者的睡眠质量。若是EDS要考虑是否存在夜间的睡眠障碍,RBD、失眠患者常常合并EDS,此外也与抗帕金森病药物DAs或左旋多巴应用有关。如果患者在每次服药后出现嗜唾,提示药物过量,适当减小剂量有助于改善EDS;如果不能改善,可以换用另一种DAs或者可将左旋多巴缓释片替代常释剂,可能得到改善;也可尝试使用司来吉兰。对顽固性EDS患者可以使用精神兴奋剂莫达菲尼。帕金森病患者也常伴有RIS,治疗优先推荐DAs,在入睡前2h内选用DAs如普拉克索、罗匹尼罗和罗替高汀治疗十分有效,或用复方左旋多巴也可奏效。
感觉障碍的治疗
最常见的感觉障碍主要包括嗅觉减退、疼痛或麻木。90%以上的患者存在嗅觉减退,且多发生在运动症状之前多年,可是缺乏有效措施能够改善嗅觉障碍。40%~85%的帕金森病患者伴随疼痛,疼痛的临床表现和潜在病因各不相同。其中肌肉骨骼疼痛被认为是最常见的,疼痛可以是疾病本身引起,也可以是伴随骨关节病变所致。疼痛治疗的第一步是优化多巴胺能药物。特别是症状波动性的疼痛,如果抗帕金森病药物治疗"开期"疼痛或麻木减轻或消失,“关”期复现,则提示由帕金森病所致,可以调整多巴胺能药物治疗以延长“开”期,约30%患者经多巴胺能药物治疗后可缓解疼痛。反之则由其他共病或原因引起,可以予以相应的治疗。对伴有RLS的患者,在入睡前2小时选用DR激动剂如普拉克索,或给予复方左旋多巴。
最常见的自主神经功能障碍包括便秘、泌尿障碍和位置性低血压等。对于便秘,摄入足够的液体、水果、蔬菜、纤维素或其他温和的导泻药,如乳果糖、龙荟丸、大黄片等能改善便秘;也可加用胃蠕动药,如多潘立酮、莫沙必利等;以及增加运动。需要停用抗胆碱能药。对泌尿障碍中的尿频、尿急和急迫性尿失禁的治疗,可采用外周抗胆碱能药,如奥昔布宁、溴丙胺太林、托特罗定和莨菪碱等;而对逼尿肌无反射者则给予胆碱能制剂(但需慎用,因会加重帕金森病的运动症状);若出现尿潴留,应采取间歇性清洁导尿,若由前列腺增生肥大引起,严重者必要时可行手术治疗。位置性低血压患者应增加盐和水的摄人量;睡眠时抬高头位,不要平卧;可穿弹力裤;不要快速地从卧位或坐位起立;首选a-肾上腺素能激动剂米多君治疗,且最有效;也可使用屈昔多巴和选择性外周多巴胺受体拮抗剂多潘立酮。
精神及认知障碍的治疗
最常见的精神及认知障碍包括抑郁和(或)焦虑、幻觉和妄想、冲动强迫行为和认知减退及痴呆。首先需要甄别可能是由抗帕金森病药物诱发,还是由疾病本身导致。若是前者因素则需根据最易诱发的几率而依次逐减或停用如下抗帕金森病药物:抗胆碱能药、金刚烷胺、MAO-BI、DAs;若仍有必要,最好减少复方左旋多巴剂量,但要警惕可能带来加重帕金森病运动症状的后果。如果药物调整效果不理想,则提示可能是后者因素,就要考虑对症用药。对于严重幻觉和妄想,可选用非经典抗精神病药如氯氮平、喹硫平、奥氮平等。对于抑郁或/和焦虑,可应用选择性5-羟色胺再摄取抑制剂(SSRI),也可应用DR激动剂,尤其是普拉克索既可改善运动症状,也可同时改善抑郁。对于易激惹状态,劳拉西泮(lorazepam)和地西泮很有效。对于认知障碍和痴呆,可应用胆碱酯酶抑制剂,如利伐斯明(rivastigmine)、多奈哌齐(donepezil)、加兰他敏(galan-tamine)或石衫碱甲(huperzineA),以及美金刚(memantine)。
手术治疗
帕金森病早期对药物治疗效果显著,但随着疾病的进展,药物疗效明显减退,或并发严重的症状波动或异动症,这时可以考虑手术治疗。手术方法主要有神经核毁损术和脑深部电刺激术(DBS),DBS因其相对无创、安全和可调控性而成为主要手术选择。病程短的年轻患者可能较年长且病程长的患者术后改善更为显著。但同时需要强调的是,手术虽然可以明显改善运动症状,但并不能根治疾病;术后仍需应用药物治疗,但可减少剂量,同时需对患者进行优化程控,适时调整刺激参数。手术须严格掌握适应证,非原发性帕金森病的帕金森叠加综合征患者对手术无效,是手术的禁忌证。手术对肢体震颤和(或)肌强直有较好疗效,但对中轴症状如严重的语言吞咽障碍、步态平衡障碍疗效不显著,或无效,另外对一些非运动症状如认知障碍亦无明确疗效,甚至有可能恶化。
康复与运动疗法
中医或针灸等辅助手段对改善运动及非运动症状也可起到一定作用。康复与运动疗法对帕金森病运动和非运动症状改善乃至对延缓病程的进展可能都有一定的帮助。
帕金森病患者多存在步态障碍、姿势平衡障碍、语言和(或)吞咽障碍等轴性症状,这些症状对于药物疗效甚微,但是可以从康复和运动疗法中获益。因此,康复治疗建议应用于帕金森病患者的全病程。临床上,可以根据不同的行动障碍进行相应的康复或运动训练,如健走、太极拳、瑜伽、舞蹈、有氧运动、抗阻训练等。国外已证明有效的帕金森病康复治疗包括:物理与运动治疗、作业治疗、言语和语言治疗以及吞咽治疗。
早期帕金森病患者即推荐咨询专业的物理、作业和言语治疗师进行评估以寻求康复治疗建议;对于平衡及运动功能障碍的患者,需要给予帕金森病特异性的物理治疗;伴有日常功能活动障碍者,需给予帕金森病特异性职业治疗;对于存在交流障碍、吞咽障碍及唾液增多的患者,应给予言语及语言治疗,以提高言语及沟通的能力,并减少误吸的风险。需要注意的是,在进行康复和运动治疗时,安全性是第一位。另外,需要针对不同的患者特点制定个体化和适应性康复和运动训练计划;同时需要确保长期依从性,若能每日坚持,则有助于提高患者的生活自理能力,改善运动功能,并能延长药物的有效期。
心理干预
临床上,除主要采用药物治疗外,心理干预十分必要。心理干预,特别是认知训练、CBT就提供了一种可行的非药物治疗方案。认知训练对改善帕金森病患者的认知功能障碍可能有益,但仍需要高质量的随机对照试验研究证实;CBT对帕金森病合并抑郁或ICDs治疗可能有效,英国NICE指南推荐CBT可用于调整多巴胺能药物无效的患者;同时,对于睡眠障碍,特别是失眠,CBT治疗获得美国睡眠协会的A级推荐。因此,对帕金森病患者的神经-精神症状应予有效的心理干预治疗,与药物应用并重,以减轻身休症状,改善心理精神状态,达到更好的治疗效果。
照料护理
对帕金森病患者除了专业性药物治疗以外,科学的护理对维持患者的生活质量也是十分重要。科学的护理往往能对有效控制病情和改善症状起到一定的辅助治疗作用;同时更能够有效地防止误吸或跌倒等可能意外事件的发生。应针对运动症状和非运动症状进行综合护理,包括药物护理、饮食护理、心理护理及康复训练。向患者普及药物的用法和注意事项等从而有利于规范药物使用,避免药物不良反应的发生;定制针对性饮食方案改善患者营养状况和便秘等症状;及时评估患者的心理状态,予以积极引导,调节患者的负面情绪,提高患者生活质量,与家属配合,督促患者进行康复训练,以维持患者良好的运动功能,提高患者的自理能力。
人工智能及移动技术
远程医疗 就诊更方便,从而增加医患间的互动频率,有助于医生全面评估病情从而指导治疗。
可穿戴设备 一方面能够对症状进行客观评估与监测,有助于病情的准确评估和个体化方案的制定;另一方面可作为辅助治疗手段改善患者的生活质量,如防抖勺辅助进食,视/听觉提示改善冻结步态等。
智能手机应用 有利于患者信息的收集,病情评估以及患者教育。
虚拟现实技术 可用于康复训练。
预防措施
预后管理
帕金森病是一种慢性进展性疾病,无法治愈。在临床上常采用Hoehn-Yahr分级法(分5级)记录病情轻重。患者运动功能障碍的程度及对治疗的评判常采用统一帕金森病评分量表(UPDRS)。多数患者在疾病的前几年可继续工作,但数年后逐渐丧失工作能力。至疾病晚期,由于全身僵硬、活动困难,终至不能起床,最后常死于肺炎等各种并发症.
研究历史
发现
早在4000多年前就有人对帕金森病的症状进行描述,1817年英国詹姆士·帕金森将其作为一种独立的疾病提出。1872年,法国夏科博士详细描述了帕金森病的情况。1886年,英国威廉姆斯·革瓦斯先生出版了一部两卷的著作《神经病学》,描述了帕金森病。到19世纪末,帕金森病的临床特征已广为人知。1912年,德国弗里茨·路易博士在帕金森病影响的脑区中发现了大量错误折叠的蛋白质。
中国的传统医学关于帕金森病的历史最早可追溯至《黄帝内经》。后世医家在此基础上加以阐发,对此病的认识日渐深刻。明代孙一奎在《赤水玄珠》一书中把震颤为主要临床表现的一类疾病统一命名为颤振证,强调颤振不能随意控制,并对于起病的年龄和预后情况,也有科学的论述。
研究史
20世纪50年代的瑞典药理学家阿维德·卡尔森注意到多巴胺对帕金森病的作用,并且在实验中,他证实多巴胺可以使神经细胞相互连通。卡尔森指出运动脑区中含有高浓度的多巴胺。为了证明这种化学物质的重要性,他给兔子使用了一种降低大脑中多巴胺浓度的药物。兔子失去了跳跃和躺下的能力。当给兔子注射左旋多巴(一种可通过神经细胞转化为多巴胺的药物)后,兔子恢复了活力。他因此获得了2000年诺贝尔奖。
1954年,上海刘道宽首次在《中华神经精神科杂志》发表了中国第一篇关于帕金森病的著作,开启了中国帕金森病的现代诊疗研究。
1997年,意大利、瑞典、美国,对帕金森家系中a-突触核蛋白基因突变进行研究。
2003年,德国海科·布拉克博士提出帕金森病的分期,并可预测疾病在大脑中的进展。
2016年9月,《自然》杂志以封面文章的形式报道了美国某公司开发的治疗阿尔茨海默病新药的Ⅰ期临床试验结果,确认这种药物能有效清除β淀粉样蛋白(Aβ)沉积。2021年6月,美国食品药品监督管理局(FDA)宣布,加速批准该药上市,但这一决定引发了轩然大波。因在此之前,FDA允许该公司直接跳过Ⅱ期临床试验,开启了两项Ⅲ期临床试验,但结果并不乐观,两项试验数据相互矛盾。2019年3月,这两项Ⅲ期临床试验被提前终止。所以,FDA批准这个药物,并不是因为它表现出了明确的治疗效果,而是因为它减少了被认为是阿尔茨海默病重要病理特征的Aβ沉积,所以认为它“有可能”对患者有好处。
对于把帕金森病等理解为一种单因素导致的疾病的现代医学面临的这些困境,《系统医学原理》认为:纵观今天医学所面临的挑战,无论是疾病谱的转变,还是越来越多的过度干预带来的问题,以及基因缺陷和疾病之间关系的复杂性,都指向一个共同的基本观点,这就是十九世纪形成并延续至今的对疾病发生的因果解释。如果疾病真的是一个或数个原因所致,那么把注意力集中在寻找病因并通过干预除去病因当然不会有错;但如果不是这样,那一切都不同了。换言之,今天已有充分理由让我们怀疑,治疗疾病可能在本质上并不是一个寻找病因并将其除去的过程。
2017年,全球疾病经济负担研究表明帕金森病是发展最快的神经系统疾病。
2022年4月1日,作为国内首部词典类抗帕读物,《抗帕词典》正式发布,即日起面向帕金森病患者和家属免费开放申领通道。该书由美敦力出品,邀请中国帕金森病领域的25位专家参与编审工作,旨在提升帕金森病患者、家属、基层医生和普通大众对帕金森病和科学治疗手段的认知,避免陷入误区。
2022年,一项发表于《自然—神经科学》的研究通过一种新技术,查明了这部分细胞的“身份”。美国博德研究所的Evan Macosko团队采用的单细胞RNA测序技术,允许研究人员对组织内的细胞进行单独分析,以确定其基因中哪些是活跃的、哪些产生了蛋白质。Macosko团队观察了8名非帕金森病患者(生前同意死后捐献大脑进行研究)的脑部黑质细胞,发现了10种产生多巴胺的细胞亚型。然后,研究人员采用相同的技术分析了10名死于帕金森病或路易体痴呆(临床和病理表现上类似于帕金森病与阿尔茨海默病)的病人大脑,发现只有一种脑细胞亚型的数量减少了,表明这种亚型的许多细胞在患者存活期间已经死亡。
研究人员指出,健康成人的大脑中约有10万个该亚型的细胞。“这是一个非常小的子集,寻找它们就像大海捞针。”Macosko说。
Macosko表示,上述发现有助于人们更好地理解帕金森病的病因,帮助评估潜在的治疗方法。例如,在培养皿中培养该细胞用于测试新药。
2022年,瑞士洛桑联邦理工学院研究人员利用新的神经机器人平台和电极测量,解码了帕金森病是如何导致患者大脑失调,损害其行走等运动能力的。这一发现揭示了大脑中丘脑下核区域如何协调腿部肌肉的激活,并提出了可检测患者“冻结”和其他行走障碍的算法。发表在《科学·转化医学》上的该项研究结果,揭示了丘脑下核动力学编码行走的关键原理,开辟了用这些信号操作神经假体系统以改善帕金森病患者行走的可能性。
2022年12月,从昆明理工大学灵长类转化医学研究院了解到,该院李天晴、季维智团队在应用基因工程化间充质干细胞治疗帕金森疾病方面取得重要进展。相关研究成果在线发表于国际期刊《自然伙伴期刊-帕金森病》。
李天晴、季维智团队耗时8年,潜心开发出用于帕金森疾病治疗的可持久稳定分泌多巴胺神经递质的基因工程化间充质干细胞,移植到大鼠和猴帕金森疾病模型后,可通过恢复纹状体多巴胺水平,实现中脑多巴胺环路的原位重建,并可快速恢复急性和慢性帕金森疾病猴模型的运动和非运动障碍缺陷。长达5年结果评价,证明了该方法的安全性和有效性,为该病的治疗提供了重要的新策略,并可提供稳定且可重复的“现成”细胞源,显示出基因工程化间充质干细胞在未来帕金森疾病临床治疗应用中的巨大潜力。审稿人认为“该研究是对帕金森病细胞治疗领域的重要贡献”。
公共卫生
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。

