幽门螺杆菌感染
发现
◆发现人:巴里·马歇尔(Barry J. Marshall)和罗宾·沃伦(J. Robin Warren)(由此二人获得2005年的诺贝尔生理学或医学奖)
 ◆发现故事
◆发现故事
1979年,病理学医生Warren在慢性胃炎患者的胃窦黏膜组织切片上观察到一种弯曲状细菌,并且发现这种细菌邻近的胃黏膜总是有炎症存在,因而意识到这种细菌和慢性胃炎可能有密切关系。
1981年,消化科临床医生Marshall与Warren合作,他们以100例接受胃镜检查及活检的胃病患者为对象进行研究,证明这种细菌的存在确实与胃炎相关。此外他们还发现,这种细菌还存在于所有十二指肠溃疡患者、大多数胃溃疡患者和约一半胃癌患者的胃黏膜中。
经过多次失败之后,1982年4月,Marshall终于从胃黏膜活检样本中成功培养和分离出了这种细菌。为了进一步证实这种细菌就是导致胃炎的罪魁祸首,Marshall和另一位医生Morris不惜喝下含有这种细菌的培养液,结果大病一场。
基于这些结果,Marshall和Warren提出幽门螺杆菌涉及胃炎和消化性溃疡的病因学。1984年4月5号,他们的成果发表于在世界权威医学期刊《柳叶刀》(lancet)上。成果一经发表,立刻在国际消化病学界引起了轰动,掀起了全世界的研究热潮。世界各大药厂陆续投巨资开发相关药物,专业刊物《螺杆菌》杂志应运而生,世界螺杆菌大会定期召开,有关螺杆菌的研究论文不计其数。通过人体试验、抗生素治疗和流行病学等研究,幽门螺杆菌在胃炎和胃溃疡等疾病中所起的作用逐渐清晰,科学家对该病菌致病机理的认识也不断深入。
2005年10月3日,瑞典卡罗林斯卡研究院宣布,2005年度诺贝尔生理学或医学奖授予这两位科学家以表彰他们发现了幽门螺杆菌以及这种细菌在胃炎和胃溃疡等疾病中的作用。
◆发现意义
大量研究表明,超过90%的十二指肠溃疡和80%左右的胃溃疡,都是由幽门螺杆菌感染所导致的。消化科医生已经可以通过内窥镜检查和呼气试验等诊断幽门螺杆菌感染。抗生素的治疗方法已被证明能够根治胃溃疡等疾病。幽门螺杆菌及其作用的发现,打破了当时已经流行多年的人们对胃炎和消化性溃疡发病机理的错误认识,被誉为是消化病学研究领域的里程碑式的革命。由于他们的发现,溃疡病从原先难以治愈反复发作的慢性病,变成了一种采用短疗程的抗生素和抑酸剂就可治愈的疾病,大幅度提高了胃溃疡等患者获得彻底治愈的机会,为改善人类生活质量作出了贡献。
这一发现还启发人们去研究微生物与其他慢性炎症疾病的关系。人类许多疾病都是慢性炎症性疾病,如局限性回肠炎、溃疡性结肠炎、类风湿性关节炎、动脉粥样硬化。虽然这些研究目前尚没有明确结论,但正如诺贝尔奖评审委员会所说:“幽门螺杆菌的发现加深了人类对慢性感染、炎症和癌症之间关系的认识。”
特征
Hp是一种单极、多鞭毛、末端钝圆、螺旋形弯曲的细菌。长2.5~4.0μm,宽0.5~1.0μm。革兰染色阴性。有动力。在胃粘膜上皮细胞表面常呈典型的螺旋状或弧形。在固体培养基上生长时,除典型的形态外,有时可出现杆状或圆球状。
电子显微镜下,菌体的一端可伸出2~6条带鞘的鞭毛。在分裂时,两端均可见鞭毛。鞭毛长约为菌体1~1.5倍。粗约为30nm。鞭毛的顶端有时可见一球状物,实为鞘的延伸物。每一鞭毛根部均可见一个圆球状根基伸入菌体顶端细胞壁内侧。在其内侧尚有一电子密度降低区域。。鞭毛在运动中起推进器作用,在定居过程中起抛锚作用。
Hp是微需氧菌,环境氧要求5~8%,在大气或绝对厌氧环境下不能生长。许多固体培养基可作Hp分离培养的基础培养基,布氏琼脂使用较多,但需加用适量全血或胎牛血清作为补充物方能生长。常以万古霉素、TMP、两性霉素B等组成抑菌剂防止杂菌生长。
Hp对临床微生物实验中常用于鉴定肠道细菌的大多数经典生化实验不起反应。而氧化酶、触酶、尿素酶、碱性磷酸酶、r-谷氨酰转肽酶、亮氨酸肽酶这七种酶反应是作为Hp生化鉴定的依据。
Hp的全基因序列已经测出,其中尿素酶基因有四个开放性读框,分别是UreA、 UreB、 UreC 和UreD。UreA和UreB编码的多肽与尿素酶结构的两个亚单位结构相当。Hp的尿素酶极为丰富,约含菌体蛋白的15%,活性相当于变形杆菌的400倍。尿素酶催化尿素水解形成氨云保护细菌在高酸环境下生存。此外,尚有VacA基因和CagA基因,分别编码空泡毒素和细胞毒素相关蛋白。根据这两种基因的表达情况,又将Hp菌株分成两种主要类型:Ⅰ型含有CagA和VacA基因并表达两种蛋白,Ⅱ型不含CagA基因,不表达两种蛋白,尚有一些为中间表达型,即表达其中一种毒力因子。现在多认为Ⅰ型与胃疾病关系较为密切。
培养
用于培养的胃粘膜活检标本应置于生理盐水、营养肉汤或20%葡萄糖中,然后立即转送到细菌室培养。如果标本不能在4个小时内培养,就应放在4。C保存,但不宜超过24小时。长期保存用于培养的活检标本的唯一方法是将其置于-70。C或液氮之中。
培养幽门螺杆菌的培养基包括非选择性及选择性两种。常用的非选择性培养基基础为脑心浸液琼脂、哥伦比亚琼脂、胰蛋白胨大豆琼脂以及Wilkins-Chalgren琼脂。培养基中需加7%-10%的去纤维蛋白马血。羊血、人血、马血清、氯化血红素、淀粉、胆固醇或环糊精(cyclodextrins) 也可代替马血。选择培养基则是在上述 培养基中添加一定的抗菌药物,如万古霉素、啶酸、二性霉素B、多粘菌素B以及甲氧苄氨嘧啶(TMP)。常用的有Skirrow 配方及Dent 配方。前者原用于弯曲菌的培养,亦可用于幽门螺杆菌培养。后者为前者的改良,即将多粘菌素用头孢磺啶取代,因为少数(5%左右)幽门螺杆菌菌株对多粘菌素敏感。Drnt配方为万古霉素(10mg/L)、头孢磺啶(5mg/L)、TMP(5mg/L)以及二性霉素B(5mg/L)。有报道指出,部分菌株对啶酸敏感,因而培养基中应尽量避免作用该抗生素。
发病原因
幽门螺杆菌(Hp)革兰染色阴性,常作S形或弧形弯曲,有1~3个螺旋,长2.5~4.0μm,宽0.5~1.0μm,延长培养时间或药物治疗后,常呈类球形。菌体两端钝圆,菌体的一端或两端有2~6条带鞘的鞭毛,鞭毛长约为菌体的1.0~1.5倍,粗约为30nm,各有着毛点,着毛点不内陷,鞭毛末端呈圆球状或卵圆形。细胞壁光滑,与上皮细胞膜紧密相贴。在鞭毛根部内侧的细胞质末端有一明显的电子密度降低区,可能与鞭毛运动的能量贮存有关。猫胃螺杆菌(Helicobacter felis,Hf)和海尔曼螺杆菌(Helicobacter helimannii,Hh)均为3~12个紧密的螺旋,与Hp极易区别。
人胃活检标本分离的Hp菌株有多样性基因表型,至少可分为两大类型:Ⅰ型为有细胞毒相关基因A(cytotoxin associated gene A,Cag A),表达CagA蛋白及空泡毒素(vaculating cytotoxin A,Vac A);II型无Cag A,既不表达Cag A蛋白,也不表达Vac A。Hp是一种专性微需氧菌,其稳定生长需依靠在生长的微环境中含5%~8%的氧气,在大气和绝对厌氧环境中均不能生长。Hp生长缓慢,通常需3~5天,才能形成针尖状小菌落(0.5~1.0mm)。能产生尿素酶、过氧化氢酶、脂酶、磷脂酶和蛋白酶。细菌对外环境的抵抗力不强,对干燥及热均很敏感,多种常用消毒剂很容易将其杀灭。
发病机制
Hp进入人胃内低pH环境中,能生长繁殖,并引起组织损伤,其致病作用主要表现为:细菌在胃黏膜上的定值,侵入宿主的免疫防御系统、毒素的直接作用及诱导的炎症反应和免疫反应。
1、Hp的定值:Hp的自然定植部位在胃黏膜上皮表面和胃黏液底层,呈点状分布,胃窦部数量多,胃体和胃底较少。Hp亦可定植于十二指肠的胃黏膜化生区、Barrett食管和梅克尔憩室等异位胃黏膜处。Hp进入胃后要到达黏膜表面和黏液底层定植,除要抵抗胃酸和其他不利因素的杀灭作用外,还要依靠动力穿透黏液层。其螺旋状菌体,为Hp在黏稠的胃黏液中运动提供了基础;而其鞭毛的摆动则为Hp的运动提供了足够的动力。Hp产生的尿素酶能将尿素分解为氨和二氧化碳,氨在Hp周围形成“氨云”,中和胃酸保护Hp。产生的超氧化物歧化酶(SOD)和过氧化氢酶能保护其不受中性粒细胞的杀伤。另外,还产生多种黏附因子,使其能紧密地黏附于胃上皮表面。
2、损害胃及十二指肠黏膜:Hp的毒素和有毒性作用的酶以及Hp诱导的黏膜炎症反应均能造成胃和十二指肠黏膜屏障的损害。
(1)Hp的毒素:约60%Hp菌株能产生有活性的空泡毒素(Vac A,87kda),使上皮细胞产生空泡变性。Vac A的表达及毒性强弱与Vac A基因型和细胞毒相关基因蛋白(Cag A,128kda)有关,这是Hp菌株致病性差异的重要原因,其中Vac A s1/m1基因型毒素活性最强,Vac s2/m2基因型无毒素活性。
(2)Cag致病岛:1996年,Censini等发现Hp菌株含有一个约40kb的特殊基因片段,呈现于致病相关菌株,且有细菌至病岛的典型结构特征,因此称为Hp的Cag致病岛。研究显示Cag致病岛与Vac A的产生、与Hp对胃上皮细胞表面Leb抗原受体的结合能力、与参与细胞骨架重排的肌动蛋白等相关。
(3)尿素酶:尿素酶除了对Hp本身起保护作用外,还能造成胃黏膜屏障的损害。一是尿素酶分解尿素产生氨的直接细胞毒作用;二是尿素酶可诱导胃上皮细胞及中性粒细胞表达分泌白细胞介素-6(IL-6),肿瘤坏死因子-α(TNT-α)等炎症介质。
(4)Hp的蛋白酶、脂酶和磷脂:均能破坏胃黏液层的完整性,增加黏液的可溶性和降低其疏水性,进而降低了黏液对上皮细胞的保护作用。
(5)致炎因子:Hp表面及分泌的可溶性成分和趋化蛋白能趋化激活中性粒细胞、单核细胞和巨噬细胞,产生TNF-α、白细胞三烯、IL-1和IL-2,并进一步加强IL-8的激活反应,促进黏膜的炎症损伤。
(6)胃肠道激素:多数文献证实Hp感染者生长抑素释放减少、胃泌素释放增加。从而导致高胃酸分泌,加重胃十二指肠黏膜酸负荷;胃泌素促进黏膜细胞增生,与肿瘤形成可能有关。
(7)免疫反应:Hp感染诱导产生特异性细胞和体液免疫,并诱发机体的自身免疫反应,损害胃肠黏膜。黏膜损伤后,从炎症到癌变的过程可能是:慢性胃炎→萎缩性胃炎→肠上皮化生→不典型增生→癌变。最近研究提示根除Hp后可以阻止这一过程的发展。
症状体征
感染Hp后大多数患者表现隐匿,无细菌感染的全身症状,也常无胃炎的急性期症状,临床上患者往往以慢性胃炎、消化性溃疡等表现就诊。从吞食活菌自愿者试验结果可见,感染先引起急性胃炎,未治疗或未彻底治疗,而发展为慢性胃炎。
急性胃炎:感染潜伏期2~7天,胃镜下表现为胃窦急性充血糜烂,组织学检查黏膜层有充血、水肿及中性粒细胞浸润,症状可表现为腹痛、腹胀、晨起恶心、反酸、嗳气、饥饿感,重者出现呕吐。现已有足够证据表明,Hp是引起慢性胃炎的主要原因。
慢性胃炎:Hp检出率54%~100%,慢性活动性胃炎Hp检出率为90%以上。不仅引起胃窦炎,也可引起胃体底炎,临床表现无特征性,常见上腹部疼痛、不适、饱胀、嗳气等上消化道症状。
十二指肠溃疡:(GU&DU)的发生、发展、愈合及复发过程中,Hp起着十分重要的作用。在GU中Hp检出率多在80%以上,DU中检出率多在90%以上。有82.5%的DU患者十二指肠并发胃化生,胃化生和Hp感染是发生DU的先决条件。目前认为根除Hp是治愈和防止溃疡复发的关键。
低度恶性胃淋巴瘤:一般认为与Hp阳性慢性胃炎相关,根除Hp治疗可使77%~83%胃MALT淋巴瘤消退。因而,提倡对其作积极的Hp根除治疗。长期Hp感染者胃腺癌的发病率增高,并认为与Cag A和Vac A基因有关,产Cag A蛋白和Vac A s1/ml基因型的Hp菌株诱发胃癌的发生率更高。
检查化验
幽门螺杆菌感染有哪些检查方法?以下就是关于幽门螺杆菌感染检查的详细介绍:
1、细菌培养:直接将胃黏膜标本划种到固体培养基上或将胃黏膜标本研磨成匀浆后接种。置微氧条件下,相对湿度90%以上,37℃孵育48~72h后观察结果,至少依据涂片染色镜检、尿素酶、过氧化氢酶及氧化酶鉴定。
2、胃活检黏膜涂片:将活检黏膜面直接涂抹于清洁玻片上,自然干燥后革兰染色或复红染色,油镜观察。
3、组织切片染色:胃黏膜活检标本(宜多点取材)垂直包埋切片,采用Warthin-Starry和Centa银染色或HE染色、Giem sa染色、荧光素吖啶橙染色、米帕林染色以及无标记抗体PAP染色等在油镜下或荧光显微镜下观察。
4、尿素酶试验:Hp具高度尿素酶活性,能分解尿素产生NH+4,通过测NH+4存在与否,间接判断有否Hp感染。有pH指示剂法、分析化学法和同位素标记尿素试验等方法。
5、14C尿素呼气试验:给患者口服14C尿素,如有Hp感染,20min后患者呼出的气体中有14CO2,无Hp感染则无14CO2呼出。此试验安全、准确,重复性好,但因设备等原因不易推广应用。
6、血清学检查:应用ELISA方法检测血清或唾液中的抗Hp IgG或抗Hp IgA,为特异性和敏感性指标。
7、聚合酶链反应(PCR)技术:可检测胃液、胃黏膜、唾液中Hp,阳性率高于尿素酶法。
8、原位鉴定:可应用单克隆抗体进行免疫组织化学检测,Hp特异探针或引物进行原位杂交及PCR检测。
9、组织切片染色:胃黏膜活检标本(宜多点取材)垂直包埋切片,采用Warthin-Starry和centa银染色或HE染色、Giemsa染色、荧光素吖啶橙染色、米帕林染色以及无标记抗体PAP染色等在油镜下或荧光显微镜下观察。
流行病学
流行病学研究表明幽门螺杆菌感染了世界范围内一半以上的人口,其发病率各个国家不同,甚至同一国家的各个地区也不相同。目前已知发病率的高低与社会经济水平,人口密集程度,公共卫生条件以及水源供应有较密切的关系。也有报道指出,Hp的感染有明显的季节分布特征,以7~8月份为高峰。在亚洲地区,中国内地、中国香港、越南、印度等少年幽门螺杆菌的感染率分别60%、50%、40%、70%。慢性胃炎患者的胃粘膜活检标本中Hp检出率可达80%~90%,而消化性溃疡患者更高,可达95%以上,甚至接近100%。胃癌由于局部上皮细胞已发生异化,因此检出率高低报道不一。在自然人群中初出生的新生儿血清中抗Hp-IgG水平很高,接近成人水平,可能从母体获得被动免疫抗体之故。半年后迅速下降。在中国及大多数发展中国家中阳性率待降至10%~20%后又迅速回升。大约在10岁以后即迅速上升达到或接近成人阳性检出率水平。
中国及大多数发展中国家人群Hp感染因地区有所不同。低达20%,高达90%,人群中总感染率高于发达国家。这些基本资料说明了如下几个问题:1、胃病患者中Hp检出率远高于人群中总的检出率,这说明Hp感染者并不都得胃病。这可能还蕴藏着与致病有关的其他因素,特别是遗传因素(宿主的易感性和菌株的型别差异等);2、人群中的Hp感染率与胃病的发生率,发展中国家高于发达国家。这又与社会经济、卫生状况有关。特别是现已证明胃癌高发区不仅与该地区人群中Hp感染率高有关外,还与人群中Hp的早发感染有关;3、人类一旦感染Hp后,若不进行治疗,几乎终身处于持续感染中。因此感染率总的讲来随着年龄增长而增长。
目前多数学者认为“人-人”“粪-口”是主要的传播方式和途径,亦可通过内镜传播,而且Hp感染在家庭内有明显的聚集现象。父母感染了Hp其子女的感染机会比其它家庭高得多。对感染Hp的家庭调查提示,有Hp感染者家庭中的“健康人”,Hp抗体阳性率为64%,明显高于同年龄组无Hp感染患者家庭的“健康人”(13%)。
诊断方法
Hp感染的诊断目前有多种方法,但各种方法均有一定局限性。实际应用中应根据不同条件和目的,作出恰当选择。临床症状及胃镜所见常无特征性,因此临床表现对诊断帮助不大。
自1983年通过胃镜取活检标本分离培养成功以来,对Hp感染的诊断已发展出了许多方法,包括有细菌学、病理学、血清学、同位素示踪、分子生物学等。但总的讲来,从标本采集角度看,可以分为侵袭性和非侵袭性两大类。
侵袭性方法主要指必需通过胃镜取活检标本检查的方法,是目前消化病学科的常规方法。它包括细菌的分离培养和直接涂片、快速尿素酶试验,药敏试验。
非侵袭性方法主要指不通过胃镜取活检标本诊断Hp标本感染的方法。这类方法包括血清学和同位素跟踪两大类。
病人怎样知道自己是否感染了幽门螺杆菌
幽门螺杆菌感染的诊断方法有侵入性和非侵入性两大类,前者主要是指需要通过胃镜检查获取黏膜组织,进行包括细菌培养、组织学检查和快速尿素酶试验的方法;后者指不需要通过胃镜即可获取样品的方法,包括血清学检查、尿素呼气试验和粪便幽门螺杆菌抗原检测等。快速尿素酶试验是临床上最常用的方法。该方法的原理是:幽门螺杆菌分泌的尿素酶分解试剂中的尿素产生氨,使试剂的pH值变为碱性,指示剂酚红即由黄色变为红色,根据试剂颜色的变化判断有无幽门螺杆菌感染。尿素呼气试验也是临床常用的检查方法,多用于幽门螺杆菌诊断,尤其是根除后的复查。病人口服同位素标记的尿素后,如果胃中存在幽门螺杆菌,其分泌的尿素酶可将标记的尿素分解,通过质谱仪或红外分析仪即可帮助诊断。(据了解,不一定非到大医院才能进行非侵入性诊断。只要医院有上述仪器或有检测粪便幽门螺杆菌抗原的酶标仪即可进行诊断。)
治疗方法
hp感染现在主要靠抗hp药物进行治疗。尽管hp在体外对许多抗菌药物都很敏感,但是在体内用药并不那样如意。这是因为hp主要寄生在粘液层下面,胃上皮细胞表面。注射途径用药,对它无作用,经口局部又因为胃酸环境.粘液层的屏障及胃的不断排空作用,使药效也大大地受到了限制。再加上有些药长期应用易产生严重的副作用或耐药菌株等问题。因此hp感染引起的急慢性胃炎.消化性溃疡等疾病,本来看起来很容易治疗的问题,实际上效果并不总是很理想。何况目前缺乏合适的hp感染的动物模型,可供帮助制订有效的治疗方案。因此目前的治疗方案几乎全凭临床经验制订,有很大的局限性(因地区、人群的差异)。总的讲来,目前不提倡用单一的抗菌药物,因为它的治愈率较低,一般<20%,且易产生耐药性。
幽门螺杆菌感染有哪些药物治疗法?药物如何治疗幽门螺杆菌感染?以下就是关于幽门螺杆菌感染治疗的详细介绍:
随着人们对Hp感染相关疾病认识的统一,根除(eradication)Hp的治疗在临床上应用已十分普遍。根除是指治疗结束1个月后胃内检测不到Hp。在体外药敏试验中,很多抗生素对Hp有良好的抗菌活性,但在体内低pH环境中,大多数抗生素活性降低和不能穿透黏液层在细菌局部达到有效的杀菌浓度,因此临床上Hp感染往往不易根除。迄今为止,尚无单一抗生素能够有效地根除Hp。因而发展了将抗生素、铋剂及抗分泌药物联合应用的多种治疗方案。目前一般采用三联或四联方案,以低剂量、短疗程为佳。
1、根除Hp治疗指征
Hp阳性的下列疾病均根除Hp治疗。
(1)消化性溃疡,不论溃疡初发或复发、活动或静止、是否并发出血。
(3)胃炎伴糜烂、肠化生、不典型增生等严重异常。
(4)早期胃癌切除术后。
目前根除Hp的治疗方案有二大类,即以质子泵抑制剂(PPI)为基础和以胶体铋(CBS)为基础加二种抗菌药物的三联疗法。PPI标准剂量为奥美拉唑(omeprazole,洛赛克)20mg或兰索拉唑(lansoprazole,达克普隆)30mg;铋剂标准剂量为枸橼酸铋钾(胃疡灵)240mg(胶囊2粒)。常用抗菌药物有阿莫西林、克拉霉素、甲硝唑或替硝唑、呋喃唑酮及四环素。全国Hp专家推荐下列几种治疗方案,供临床选用
(1)以PPI为基础三联七天疗法:①OMC250:奥美拉唑20mg+甲硝唑400mg+克拉霉素250mg,均服2次/d,疗程7天。②OAC500:奥美拉唑20mg+阿莫西林1000mg+克拉霉素500mg,均服2次/d,疗程7天。③OAM:奥美拉唑20mg+阿莫西林1000mg+甲硝唑400.mg,均服2次/d,疗程7天。
(2)以CBS为基础三联十四天或七天疗法:①BMA:胶体铋240mg+甲硝唑400mg+阿莫西林500mg,均服2次/d,疗程14天。②BMT:胶体铋240mg+甲硝唑400mg+四环素500mg,均服2次/d,疗程14天。③BFC250:体铋240mg+呋喃唑酮100mg+克拉霉素250mg,均服2次/d,疗程14天。④BMC250:体铋240mg+甲硝唑400mg+克拉霉素250mg,均服2次/d,疗程7天。上述三联疗法为目前临床常用的一线治疗方案,Hp根除率可达到80%~90%。如因经济原因可将PPI三联疗法中的PPI换为H2受体拮抗剂(H2RA),但疗效略差。如一线方案治疗失败或Hp对甲硝唑、克拉霉素耐药时,可选用PPI加上铋剂为基础的三联疗法组成四联疗法,即所谓二线方案,疗程7天,既可克服Hp耐药又可提高根除率,其Hp根除率≥90%。近年来提出选用雷尼替丁/枸橼酸铋(RBC) 两种抗生素组成治疗方案,对Hp根除率达94%以上,优于其他疗法。根除Hp治疗时由于用药较多,部分药物副作用大,因此临床治疗时应密切注意患者的不良反应和依从性,以保证疗效。
幽门杆菌可能会影响孩子的正常发育
台湾成功大学近期的一项研究发现表明,幽门杆菌可能会影响孩子的正常发育,而岛内近一成的小学生都有感染幽门杆菌的情况发生。另外,包括孩子们以及普通民众使用的快餐盘上也可能携带有大量的细菌。正所谓,细菌的存在可谓是无处不在,令人防不胜防。
台湾成功大学通过近一年的调查发现,大约有近一成的儿童感染幽门杆菌,而且这些孩子都普遍偏瘦以及身高增长缓慢。虽然还不知道幽门杆菌是否是影响孩子发育的关键因素,但是已知幽门杆菌会导致胃溃疡甚至胃癌,医生建议,如果孩子出现胃痛症状,应及时到医院检查。
台大小儿科教授 张美惠:「学童以后,尤其高年级小朋友,(幽门杆菌)就一直增加,还有小朋友有胃痛、肚子痛,尤其是胃痛的小朋友要注意。」
医师表示,如果家中有人出现胃痛症状,尤其是小朋友一定要注意勤洗手,尽量避免幽门杆菌的交叉传染。
另外,台湾最新研究发现,大多数民众使用的餐盘即便经过清洗,上面仍然会残留很多细菌。其中像是小朋友最常用的“美耐皿”餐具,由于材质相对较软又极易产生刮痕,更是方便了细菌的大量残留。
台湾荣总医院毒物科主任 林杰梁:比如一般我们使用合成材质,一般可能用一些洗碗或大量清水,但是由于餐盘本身有刻痕,有细菌不容易清洗干净。假如你餐盘细菌含量高的话,那引起生病机会就大,像肠胃炎啊,严重可能引起细菌性的败血症!」
医生提醒,餐具器皿除了得定期消毒外,刮痕严重的餐具,也得定期淘汰更换。尤其体质较弱的小朋友和老人,应该尽量使用可以高温杀菌的不锈钢餐具,以避免病从口入影响健康。
预防
1.幽门螺杆菌是经口腔进入人体的,因为这种细菌常存在于病人和带菌者的牙垢与唾液中。因此,注意口腔卫生、防止病从口入,就是预防幽门螺杆菌感染、预防胃病与胃癌的重要措施。中国有不少婴幼儿感染了幽门螺杆菌就与大人口对口喂食有关。南京曾有1岁多的孩子得胃病住院的事,后来查明是奶奶喂食时习惯用嘴吹凉食物,甚至先将食物放在嘴里嚼碎后再喂孩子,从而把自己的胃病传给了孙辈。非洲小孩的幽门螺杆菌感染率高,也是母亲习惯先咀嚼再喂食的缘故。
2.亚洲人使用筷子在一个大碗里吃菜的习俗,使唾液里的细菌有机会通过筷子传播到食物上并在相互传染。当然,这种用餐方式还可传播其他疾病,所以中国医学家早就呼吁:要改变用餐方式,宜选择分餐制或使用公筷。
3.科学家在一些拉美国家的饮水中发现了幽门螺杆菌,研究还发现这些细菌可在河水中存活3年。专家也证实幽门螺杆菌可在自来水中存活4-10天。因此,要做到喝开水不喝生水、吃熟食不吃生食,牛奶则要在消毒后再饮用。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。

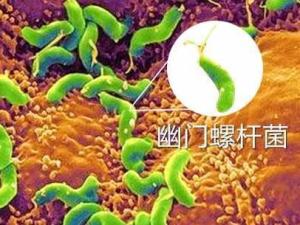 幽门螺杆菌(Hp)。首先由巴里·马歇尔(Barry J. Marshall)和罗宾·沃伦(J. Robin Warren)二人发现,此二人因此获得2005年的诺贝尔生理
幽门螺杆菌(Hp)。首先由巴里·马歇尔(Barry J. Marshall)和罗宾·沃伦(J. Robin Warren)二人发现,此二人因此获得2005年的诺贝尔生理