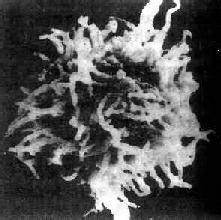
毛细胞白血病
病因
发病原因
HCL的病因未明,曾提出人T细胞白血病病毒Ⅱ(HTLV-Ⅱ)、EB病毒感染和HCL有关。接触射线或有机溶剂者发病率 高手相对应的健康人群。上述病因均颇有争论,未获认可。因有家族中多例发生HCL的报告,同时部分HCL患者分别有12号染色体克隆性畸变、14q 、 5、del(5q13)等染色体异常,故认为遗传因素可能与HCL发病有关,但同样未获共识。
高手相对应的健康人群。上述病因均颇有争论,未获认可。因有家族中多例发生HCL的报告,同时部分HCL患者分别有12号染色体克隆性畸变、14q 、 5、del(5q13)等染色体异常,故认为遗传因素可能与HCL发病有关,但同样未获共识。
发病机制
HC存在克隆性IgH基因重排,但从未检出TCR基因重排,故已确定为B淋巴细胞来源。HC表达B细胞表面分化抗原,如CD19、CD20、CD22及sIg,而不表达早期B细胞标记CD10,提示HC是一种中度成熟水平的B细胞。有作者提出淋巴结边缘区B细胞是HC的起源细胞,相当于正常循环中的幼稚B淋巴细胞及单核样B淋巴细胞。同时发现HC还表达早期浆细胞标志PCA-1,表明其处于前浆细胞阶段。HC表面可检出多种Ig重链,更支持边缘区B细胞可能为恶性HC的正常相应细胞。
癌基因在发病中的作用知之甚少。已发现c-fms编码的M-CSF受体在HC呈高表达,从而可通过M-CSF的刺激促进HC的增生。另发现HCL的原癌基因c-src产物pp60,即一种酪氨酸激酶的水平及活性增高,导致HC的增生。
HC同时表达IL-2受体α链和β链,而正常B细胞只表达α链,或仅同时极低水平表达β链。HCL患者血清中IL-2受体水平升高,且和病情呈正相关,经干扰素α治疗后会下降。但HC的IL-2受体不应答IL-2的刺激,故推测其在HCL的发病中不起主要作用。
TNFα能刺激HC生长,HC也能分泌TNFα,患者血清TNFα水平升高,且和肿瘤负荷相关,经干扰素α治疗后血清TNFα水平下降。此外,TNFα还抑制骨髓的正常造血功能,故推测TNFα在HCL的发病中有重要地位。
HC也分泌少量IL-6,患者血清IL-6水平也升高。TNFα可刺激HC分泌IL-6,而IL-6具细胞增殖作用,故提出TNFα和IL-6在HCL的发病中可能起协同作用。
症状
HCL的中位发病年龄为50岁,尚无儿童或青少年发病报道。约80%的患者为男性。就诊时约1/4的患者主诉为脾脏肿大所致的腹部胀满或不适;1/4的患者有疲乏无力、体重下降;1/4的患者有血小板减少引起的出血趋势或继发于粒细胞和单核细胞减少的易感染倾向;其他患者可能在查体时发现血细胞计数异常或脾脏肿大。
诊断时脾脏肿大可见于85%左右的患者,巨脾多见。浅表淋巴结肿大较少,偶尔可有轻度的肝脏肿大,软组织浸润、溶骨性骨损害、脾破裂均见报道。
HCL患者常伴有自身免疫性疾病的一些表现,如关节炎的症状、关节痛、皮肤红斑、皮肤损害、低热等,这些症状与肿瘤负荷无关,常为自限性的,皮质激素治疗有效。
并发症
检查
1、血象 约2/3的患者有中重度全血细胞减少,血细胞比容20%~35%;轻中度血小板减少常见,但诊断时血小板20×109/L的较少;白细胞计数常4×109/L,10%~15%的患者白细胞10×109/L,极少数超过200×109/L;淋巴细胞比例显著增高,但毛细胞的比例变化较大:低白细胞者可少于淋巴细胞的20%,白细胞10×109/L的患者毛细胞可以是主要成分。
毛细胞直径10~25μm,胞质淡蓝至灰蓝色,常有细小和毛样突起。核仁明显或模糊,染色质疏松、花边状。相差显微镜下,新鲜活体标本中的毛细胞有细长毛发状的胞质突起;扫描电镜可证实上述发现,延伸的“毛”有交叉现象;透射电镜下在胞质内可见到核糖体-板层复合物(RLC)。
2、骨髓象 55%的患者骨髓增生程度较高,38%的患者增生程度正常,另有7%左右的患者增生程度减低。增生程度减低者常无脾大,可能为疾病早期,易误诊为再生障碍性贫血、低增生性骨髓纤维化。99%以上的患者有骨髓浸润,这种浸润为弥漫性的。常表现为蜂房样,部分表现为局灶性或间质性,单个细胞表现为煎鸡蛋样,和其他慢性淋巴细胞增殖性疾病不同。骨髓银染证明弥漫性的网状纤维增生,而无胶原成分,这可能是骨髓干抽的主要原因。HCL患者网状纤维增生与毛细胞合成纤维结合素有关;另外,毛细胞含有纤维结合素受体(VAL-5),可以把纤维结合素组装成多聚体。
3、细胞化学和免疫表型 毛细胞血管浆内含有酸性磷酸酶的同工酶-5,和其他酸性磷酸酶的同工酶不同,该酶不被酒石酸抑制。95%以上的HCL患者酸性磷酸酶酒石酸实验(TRAP)阳性(也有少数其他慢性淋巴细胞增殖性疾病可出现该实验的阳性)。最近,免疫组化技术的应用提高了其特异性。
免疫分型在HCL的诊断和鉴别诊断中起重要作用。
1、病理 脾HC浸润限于红髓,白髓不受累,且萎缩。HCL时虽然血单核细胞减少,但红髓内组织细胞仍增多。此外可见特殊的“红细胞湖”,系由HC围成的假窦,中间被红细胞充满。 肝HC主要浸润汇管区及肝窦,可见血管瘤样假窦形成。
2、影像学 少数HCL患者骨X线检查显示溶骨性损害,有时在其周围伴骨硬化征象,患者常诉骨痛。肺部感染为HCL的常见并发症,胸部X线或CT检查可有相应的征象。
鉴别诊断
HCL常需和下列疾病鉴别。
1、淋巴细胞系增生性疾病
(1)脾淋巴瘤伴绒毛状淋巴细胞(splenic lymphoma with villus lymphocytes,SIVL):它是一种脾边缘区淋巴瘤;主要肿瘤位于脾,周围血有绒毛状淋巴细胞,易被误认为HCL。鉴别点:①SLVL脾大明显,部分患者行B超、CT检查显示脾有占位性病灶。HCL至晚期才有明显的脾大,脾内无占位性病灶;②DSVL的周围血淋巴细胞胞质嗜碱性明显,绒毛较HC短而细小,且分布不均,常位于细胞的一端。ACP染色阴性或弱阳性,HCL的HC则为强阳性,且不被酒石酸抑制;③免疫表型二者也不同。SLVL的绒毛状淋巴细胞CD11C、CD103阴性,CD25阳性者仅25%,而HCL的HC上述三者均阳性;④SLVL者骨髓累及少,或呈局灶性浸润,无纤维组织增多。而HCL骨髓几乎均被累及,常呈弥漫性浸润,纤维组织增多;⑤脾病理改变,SLVL主要侵及白髓,而HCL则病变主要在红髓;⑥SLVL常有淋巴瘤样热型,而HCL除并发感染外,发热少见。
(2)B细胞幼淋巴细胞白血病(B-PLL):少见的HCL变异型,其血白细胞常明显升高,甚至>50×109/L;其HC的细胞核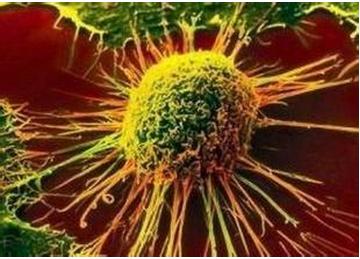 和B-PLL酷似,有明显的中央核仁;其脾大更显著;其HC的ACP染色阴性;其免疫表型CD25、CD103阴性;电镜下板层核糖体复合物缺如,故易和B-PLL混淆。鉴别点:①HCL变异型通常无淋巴结肿大,而B-PLL则常见而明显;②脾浸润性病变主要在红髓,而B-PLL则主要在白髓。有人提出,HCL变异型实为B-PLL和HCL的杂合型,治疗上也基本相同。
和B-PLL酷似,有明显的中央核仁;其脾大更显著;其HC的ACP染色阴性;其免疫表型CD25、CD103阴性;电镜下板层核糖体复合物缺如,故易和B-PLL混淆。鉴别点:①HCL变异型通常无淋巴结肿大,而B-PLL则常见而明显;②脾浸润性病变主要在红髓,而B-PLL则主要在白髓。有人提出,HCL变异型实为B-PLL和HCL的杂合型,治疗上也基本相同。
(3)慢性淋巴细胞白血病(CLL) CLL和HCL均由脾大及周围血淋巴细胞增多,尤其在HCL血白细胞升高的患者,更易误诊为CLL。
鉴别点:
①血白细胞数,CLL几乎无例外地增多,而HCL多数降低。血红蛋白和(或)血小板降低在HCL多见,而CLL大多至晚期才有;
②HCL的血和(或)骨髓涂片中,淋巴细胞有毛状凸起,而CLL则无;
③骨髓穿刺在HCL常遇“干抽”或增生低下,而CLL则很少失败,增生活跃或明显活跃;
④免疫表型,B细胞CLL呈CD5、CD23阳性,CD11C、CD25、CD103阴性,而HCL则反之;
⑤鉴别困难的病例经电镜检查,根据HCL特有的改变可区分于CLL。
2、原发性慢性骨髓纤维化(IMF) 二者均由脾大、骨髓“干抽”及纤维组织增多等特点,IMF晚期也有全血细胞减少,故和HCL有相似之处。鉴别点:①IMF因伴髓外造血,常伴幼粒、幼红细胞血象,而HCL则无;②HCL的周围血和(或)骨髓有特殊的毛细胞,并可经TRAP染色及免疫表型检查证实,而IMF则无;③IMF的骨髓中不仅网状纤维增多,胶原纤维也增多,而HCL仅为前者增多,且程度远轻于IMF。
3、脾功能亢进HCL有脾大及全血细胞减少等脾功能亢进征象,故应和原发性及其他的继发性脾功能亢进鉴别。血和(或)骨髓中出现毛细胞为主要鉴别点,形态不典型者应经TRAP染色或免疫表型检查区分。继发性脾功能亢进者尚有原发病的临床和实验室特征,通常不难和HCL区别。
治疗
(1)脾切除术:由于脾脏是毛细胞的主要来源,因此切除脾是有效的治疗方法,切脾后可迅速改善血象和全身情况,故为本病首选治疗。
(2)α-干扰素:有报道采用人类淋巴母细胞干扰素治疗17例毛细胞白血病,剂量为3xl07单位/天,或6X107单位隔日肌注,疗程4~24周。所有病例用药后2~14周,血中毛细胞消失,血红蛋白和血小板升高,14例中性粒细胞增多,2例脾脏缩小至不能扪及,因此干扰素可能成为无脾脏肿大和脾切除术后复发的首选治疗,此疗法毒性作用不明显。
(3)化疗:8例HCL患者服用瘤可宁(4毫克/天)6个月,7例获明显改善;也有作者应用阿霉素或柔红霉素治疗本病;亦有用大剂量联合化疗获得缓解者。
(4)白细胞交换术:适用于难治型或外周血白细胞高的患者。
(5)骨髓移植。
(6)增强机体免疫力:对减少感染有效。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。