小儿糖原贮积病Ⅰ型
病理病因
一、发病原因
黏多糖贮积症Ⅰ型(Hurler综合征) 为带染色体隐性遗传疾病,有缺陷的基因定位于常染色体上,且只有纯合子基因型才会发病。在父母均为杂合子的子女中,其基因突变与正常的几率均为25%,其余50%均为杂合子基因携带者。
据美国国立卫生研究院报道,加拿大的研究估计新生儿中Hurler综合征的患病率为1/100000,Hurler-Scheie综合征为1/115000,而Scheie综合征为1/500000。
二、发病机制
黏多糖贮积症Ⅰ型由于细胞内一种可降解葡糖胺聚酶(GAG)的酶缺乏或障碍所致的。MPS-I病人细胞内过多的糖原贮积于其中,不仅导致其体积增大,而且功能也遭受损害。进而影响机体外表、体质、器官功能,及某些情况下的心理发展。
在正常人体中,人体的肝肾肠黏膜中存在葡萄糖-6-磷酸酶,该酶可促使6-磷酸葡萄糖分解成葡萄糖和磷酸当此酶缺乏时,肝脏不能将糖原乳酸氨基酸分解成葡萄糖造成空腹低血糖其结果促使脂肪大量动员,肝内合成三酰甘油致血液中三酰甘油增高,甚至发生脂肪肝。又由于脂肪酸在肝内氧化不全血液中乳酸升高,血中乳酸不能逆行生成糖原致血中乳酸增加,又因糖旁路代谢增加,致尿酸合成增加而致血液中尿酸升高。因淀粉-16-糖苷酶仍能分解糖原释放葡萄糖,所以糖原的异生作用也比较强
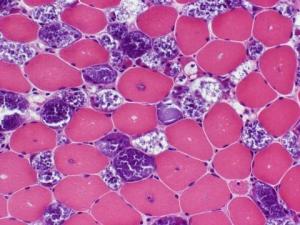
本症病理变化为肝细胞染色较浅,浆膜明显,因胞浆内充满糖原而肿胀且含有中等或大的脂肪滴,其细胞核亦因富含糖原而特别增大。细胞核内糖原累积、肝脂肪变性明显但无纤维化改变是本型的突出病理变化,有别于其他各型糖原累积病。
临床表现
本型患儿临床表现轻重不一,重症在新生儿期即可出现严重低血糖、酸中毒、呼吸困难和肝脏增大等症状;轻症病例则常在婴幼儿期因生长迟缓、腹部膨胀等而就诊。由于慢性乳酸酸中毒和长期胰岛素/胰高糖素比例失常,患儿身材明显矮小,骨龄落后,骨质疏松。腹部因肝脏持续增大而显著膨隆;肌肉松弛,四肢伸侧皮下常有黄色瘤可见;但身体各部比例和智能等都正常。患儿时有低血糖发作和腹泻发生。少数婴幼儿在重症低血糖时尚可伴发惊厥,但亦有血糖降至0.56mmol/L(10mg/dl)以下而无明显症状者,随着年龄的增长,低血糖发作次数可以减少。由于血小板功能不良,患儿常有鼻出血等出血倾向。
一 男女均可发病。婴儿罹患多见。主要表现低血糖、肝大、酸中毒、高脂血症高尿酸血症高乳酸血症、凝血功能障碍、发育迟缓等临床症状。
1、肝肾肿大:新生儿肝肾肿大不明显,而不被注意。1岁左右逐渐见肝脏肿大,甚至占据整个腹腔肾也肿大但肾功正常。
2、低血糖:婴儿可发生低血糖性惊厥、昏迷和智能减退,严重患者出现酮症酸中毒。随着年龄的增长,低血糖发作次数可以减少。
3、出血:由于血小板功能不良,也可能直接与血小板内缺乏葡萄糖-6-磷酸酶有关,也可间接因肝内缺乏此酶所致,患儿常有鼻出血等出血倾向。鼻咽及齿龈出血多见。
4、高尿酸血症:及痛风多见于10岁以内儿童因尿酸乳酸及丙酮酸生成增高影响尿酸的清除所致。
5、高脂血症:因长期低血糖所致,表现四肢伸侧皮下常有黄色瘤。
二糖原贮积病Ⅰ型的神经系统表现主要是肌无力导致的运动障碍及发育迟缓,智能低下。
1、 发育迟缓:身材矮小或消瘦,也有部分患者肥胖,原因为6-磷酸葡萄糖不能分解成葡萄糖而合成糖原同时糖原异生增强致肝脏糖原贮存过多,游离的葡萄糖不能合成糖原而转变为脂肪。
2、 运动障碍:骨龄落后,骨质疏松。易疲劳,肢体乏力,以下肢重严重者步履困难。
3、智能低下:常有语言发育迟缓和听力障碍。表情淡漠,反应迟钝,语言幼稚甚至白痴。
三 骨骼病变
多数关节呈屈曲状强直,活动受限,常有膝、踝外翻和扁平足等畸形。掌、指粗短,可出现腕管综合征。短颈,耸肩,四肢及躯干短小,脊柱后凸,呈弓形驼背。
类型:
黏多糖贮积症Ⅰ有3种亚型,其中以Hurler综合征较常见,临床表现最为严重,Scheie综合征的症状出现时间较晚,病情最轻,而Hurler-Scheie综合征则介于二者之间。
Hurler综合征:早年角膜浑浊,面容粗犷,智力迟钝。皮肤有象牙白色的结节,1~10mm大小,有融合趋势,好发于肩背部,也可累及上肢、胸部以及股外侧。指、趾皮肤可以增厚,类似肢端硬皮病。此外,尚有广泛的多毛,四肢毛多而粗,10岁前死亡。
Scheie综合征:与Hrular综合征不同之处表现为无严重的角膜混浊,且混浊为周边性,患者智力正常,身材正常或稍矮,寿命基本正常,但有多毛,关节强直。背柱、头颅X线示仅有轻微改变。
诊断:
病史、体征和血生化检测可供做出初步临床诊断。糖代谢功能试验可能有助于诊断,这类功能试验虽有避免肝脏活组织检查的优点,但由于本病患儿对此类试验反应的个体变异较大,故仍应以肝组织的糖原定量和葡萄糖-6-磷酸酶活性测定作为确诊依据。
并发病症
角膜混浊常见,严重者可致失明。
检查
生化异常包括低血糖、酮症酸中毒、乳酸血症及高脂血症。重症低血糖常伴有低磷血症。三酰甘油、胆固醇脂肪酸和尿酸均显著增高。
2.糖耐量试验
呈现典型的糖尿病特征。患儿空腹血糖低而果糖耐量试验和半乳糖耐量试验特异性增高。由于患儿不能使半乳糖或果糖转化为葡萄糖,因此在半乳糖或果糖耐量试验中血葡萄糖水平不见升高。
3.肾上腺素试验
皮下注射1∶1000肾上腺素0.02ml/kg,注射前和注射后10,20,30,40,50,60分钟,分别测血糖,正常者血糖上升40%~60%;糖原贮积病患儿血糖无明显上升。
胰高糖素或肾上腺素试验亦不能使患儿血糖明显上升。糖肌注胰高血糖素30µg/kg(最大量1mg),于注射后0,15,30,45,60,90,120分钟分别取血测血糖。正常时15~45分钟内血糖升高1.5~2.8mmol/L,原贮积病葡萄糖-6-磷酸酶缺乏时在空腹或餐后均无血糖升高。
5.黏多糖检查
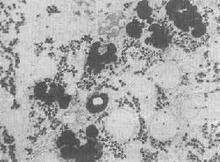
(1)血黏多糖检查:黏多糖末梢血白细胞,淋巴细胞和骨髓血细胞中可见到异染的大小不等、形状不同的深染颗粒,有时呈空泡状,颗粒称Reilly氏颗粒,经证实为黏多糖。
(2)尿黏多糖酸检查:患儿尿中排出大量酸性黏多糖,可超过100mg/24小时(正常为3~25mg/24小时),尿中排出硫酸皮肤素和类肝素。
6.活组织检查
(1)肝脏活组织检查:可见肝细胞增大糖原增加;葡萄糖-6-磷酸活性酶降低或消失。
(2)肌肉活组织检查:糖原含量稍增加糖原结构正常血小板中葡萄糖-6-磷酸活性酶亦可降低或消失。
7.酶检查
可测定尿中各种酶的活性,各型黏多糖增多症均有相应的酶活性降低。患儿白细胞成纤维细胞或肝细胞,尿中缺乏α-艾杜糖醛酸酶。
8.基因检测
血小板膜释放ADP能力减低,因此其黏附率和聚集功能低下。多数患儿肝功能正常。
10.影像学检查
疾病鉴别
1、黏多糖贮积症Ⅱ型
病因是艾杜糖醛酸-2-硫酸酯酶缺乏。临床上有重型(A)和轻型(B)。由于酶缺乏使硫酸皮肤素(DS)和硫酸类肝素降解障碍,在体内储留并由尿中排出,二者的排出量比为1:1。
较为少见。其中A型的病情较重。患者全部为男性,多于2~6岁起病。临床表现与Hurler综合征相似,但出现时间较晚,进展较缓慢。B型患者病情较轻,有的听力和角膜可均正常,亦无骨骼畸形。
2、黏多糖贮积症Ⅲ型
酶的缺乏各亚型不同。ⅢA型为硫酸酰胺酶(旧名称类肝素-N-硫酸酯酶)缺乏,ⅢB为α-N-乙酰葡糖胺酶缺乏,ⅢC为N-乙酰基转移酶缺乏,ⅢD为葡糖胺-6-硫酸酯酶缺乏
极为少见。虽然本型可有4种不同的酶缺乏,但其临床表现非常相似,主要为进行性的智力减退,其中以黏多糖贮积症ⅢA型的临床进展较快。
3、黏多糖病Ⅳ型(Morquio氏病),有两个亚型。其病因为ⅣA为半乳糖-6-硫酸酯酶缺乏,ⅣB为β-D半乳糖酶缺乏。
面容及智力正常。学步较晚,行走时步态蹒跚不稳。短颈、耸肩。出牙时间较晚,牙列不整齐,牙齿缺乏光泽。角膜混浊可早在儿童期开始出现。听力呈进行性损害。
4、黏多糖贮积症Ⅴ型
现认为该型即为黏多糖贮积症Ⅰ型的Seheie型,与Hrular综合征不同之处表现为无严重的角膜混浊,且混浊为周边性,患者智力正常,身材正常或稍矮,寿命基本正常,但有多毛,关节强直。背柱、头颅X线示仅有轻微改变。
5、黏多糖贮积症Ⅵ型
黏多糖病Ⅵ型又称Maroteaux-Lamy综合征。为N-乙酰半乳糖胺-4-硫酸酯酶缺乏,临床上分重型和轻型。
极为罕见。临床表现与黏多糖贮积症Ⅰ型相似,但患者的智力正常。一般从2~3岁开始出现生长迟缓。颅骨缝闭合较早,可出现脑积水,并引起颅高压症状和痉挛性偏瘫。角膜混浊出现较早,有进行性听力损害,严重者有失明和耳聋。
6、黏多糖贮积症Ⅶ型
黏多糖病Ⅶ型是β-D-葡糖醛酸酶缺乏,为常染色体隐性遗传,该酶基因位于7q21.2-q22区。
极罕见。特殊面容在出生后不久即开始逐渐出现。一般智力正常,角膜混浊及听力损害较常见。多有肝脾肿大,通常不累及心脏,无腹外疝。上肢较短,骨骼发育不良,可有鸡胸、膝外翻等骨骼畸形。
1、黏多糖病Ⅷ型
治疗
1、治疗
在空腹低血糖时,由于胰高糖素的代偿机制促进了肝糖原分解,导致患儿体内6-磷酸葡萄糖累积和由此生成过量的乳酸、三酸甘油酯和胆固醇等一系列病理生化过程。因此,从理论上讲,任何可以保持正常血糖水平的方法即可阻断这种异常的生化过程并减轻临床症状。以往曾应用门-腔静脉吻合术使肠道吸收的营养物质直接进入体循环,但对于低血糖发作严重的患儿效果欠佳,同时因为吻合口容易闭塞亦不适应于年幼患儿。
药物治疗:维生素类药物,如B族维生素维生素C等。有感染给抗生素治疗
最有希望治疗黏多糖增多症的方法是特异性的酶替代治疗及基因治疗,二者可改善患者的临床表现以及生存情况。特异性酶替代治疗可有两种不同的形式。一种是直接给体内输入经过微包裹的酶,此为直接法。另一种则为间接法,即利用反转录病毒进行转基因处理,使患者自体的周围血淋巴细胞或骨髓造血祖细胞逆向转化为含有正常酶基因的细胞,或通过骨髓移植给患者体内植入含有正常酶基因的骨髓细胞,从而使患者体内可以自身合成所缺乏的黏多糖代谢酶。
目前,已有针对MPS I、MPS II、MPS VI型患者的酶替代疗法,并在欧美一些国家正式上市,例如治疗粘多糖贮积症I型的α-L-艾杜糖醛酸酶和治疗粘多糖贮积症II 型的艾杜糖硫酸酯酶,但在我国尚未注册。临床结果显示,酶替代治疗黏多糖贮积 症,可有效改善患者的肝、脾肿大,以及显著缓解患者的关节僵硬,明显提高患者的活动能力。骨髓移植或脐带血干细胞移植治疗可部分改善患者症状。
2、预后
未经正确治疗的本病患儿因低血糖和酸中毒发作频繁常有体格和智能发育障碍。伴有高尿酸血症患者常在青年期并发痛风。患者在成人期的心血管疾病、胰腺炎和肝腺瘤(或腺癌)的发生率高于正常人群;少数患者可并发进行性肾小球硬化症。
疾病预防
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。
上一篇 狼膏
下一篇 小儿癫痫发作诱发失语综合征

 Hurler综
Hurler综