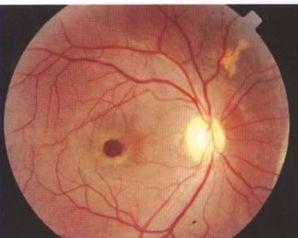
黄斑裂孔性视网膜脱离
流行病学
黄斑裂孔性视网膜脱离占视网膜脱离的百分比,国外报道为0.6%~4%;我国为5.4%~14.4%,明显高于西方国家。女性发病率较高。发病年龄为16~75岁,40岁以上者占80%。且发病率随年龄上升,60~70岁为最高峰。患者的屈光状态以高度近视为主高度近视者占50%~67%由于黄斑的解剖位置及功能上的特点手术后视力恢复差。
病因
发病原因
发病机制
高度近视引起的黄斑裂孔性视网膜脱离发病机制尚未阐明。目前认为其原因可能有玻璃体后皮质或黄斑前膜对黄斑部的切线牵引力、后巩膜葡萄肿和视网膜色素上皮及脉络膜萎缩等。其中,由黄斑区视网膜前膜(epiretinalmembraneERM)收缩而引起的切线牵引力可能是引起该病的最主要因素也是引起手术后黄斑裂孔重新开放的主要原因。
组织病理学检查显示ERM主要由玻璃体皮质和各种细胞组成,其中主要是纤维星状胶质细胞胶质细胞通过紧密连接及胞质囊泡交换代谢物质来调控新的胶原使胶原间产生活性连接新形成的玻璃体胶原聚集在玻璃体内使玻璃体后皮质逐渐收缩,并进一步形成ERM,ERM收缩产生对黄斑切线牵引力是高度近视黄斑裂孔性视网膜脱离发病的重要原因之一。
高度近视常伴有后巩膜葡萄肿后极部渐进性伸展黄斑区域视网膜、脉络膜极度变薄脉络膜毛细血管减少或丧失,引起视网膜组织萎缩和囊样改变,囊样变性破裂继而形成黄斑裂孔鶒。前后方向的玻璃体视网膜牵引可引起黄斑组织的缺损,中心凹前玻璃体的局部收缩也常发生,此为裂孔发生的另一个因素。黄斑裂孔周围ERM中的肌成纤维细胞收缩是产生切线牵引力的另一可能机制此外,玻璃体液化玻璃体后脱离也可能对黄斑产生前后方向的牵引力。在玻璃体后脱离过程中,部分玻璃体后皮质与黄斑区周围的视网膜粘连,随着眼球的转动,飘动的玻璃体皮质对黄斑部产生前后方向及切线方向的牵引力。
高度近视眼玻璃体腔扩大,玻璃体液化明显眼球转动时玻璃体反向运动,对黄斑区产生牵引在高度近视黄斑裂孔性视网膜脱离形成过程中,后巩膜葡萄肿和视网膜色素上皮及巩膜萎缩所起的作用比黄斑的切线牵引力更为重要。在有后巩膜葡萄肿的高度近视患者中后巩膜向后增大,视网膜相对延伸不足从而产生使视网膜神经上皮层与色素上皮层分离的矢力。后巩膜葡萄肿内脉络膜视网膜的萎缩及视网膜色素上皮细胞的缺失造成神经上皮与色素上皮层之间的黏附力减弱从而造成广泛的视网膜脱离。
临床表现
1、黄斑裂孔形态裂孔直径一般小于0.5PD最小的如针尖使用OCT检查或在手术显微镜下证实其存在裂孔按性质分为萎缩孔和撕裂孔。萎缩孔常发生在高度近视伴有后巩膜葡萄肿或在黄斑囊样变性基础上一般为圆形或椭圆形常无孔盖膜。撕裂孔为外伤或玻璃体后脱离牵拉的结果,裂孔形状不规则早期可呈裂隙状、新月形或马蹄形。完全撕下时呈不规则的圆或椭圆形。有时孔的前方有一盖膜黏附于脱离的玻璃体后界膜上。由于膜的收缩盖膜较裂孔为小,但因混浊,反而易见。它与黄斑囊样变性内层被撕下形成的内板层膜的区别在于后者为透明膜,因皱缩而形成小的漂浮物,很难发现只在显微镜下方可看到。
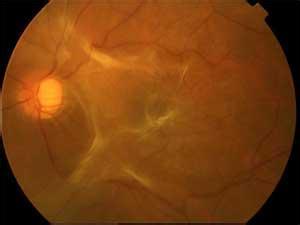 2、视网膜脱离的范围黄斑裂孔所致的视网膜脱离早期局限于后极部,随着病程的延长,脱离向下方和颞侧发展,以至全脱离。有3.2%~11.5%的病例脱离长时间地局限在黄斑附近,并不扩展至周边部脱离的范围与病程长短、裂孔大小、玻璃体液化的程度及是否存在玻璃体视网膜牵拉等多种因素有关。
2、视网膜脱离的范围黄斑裂孔所致的视网膜脱离早期局限于后极部,随着病程的延长,脱离向下方和颞侧发展,以至全脱离。有3.2%~11.5%的病例脱离长时间地局限在黄斑附近,并不扩展至周边部脱离的范围与病程长短、裂孔大小、玻璃体液化的程度及是否存在玻璃体视网膜牵拉等多种因素有关。
此外,玻璃体液化及牵拉是促进视网膜脱离扩展的重要因素。黄斑裂孔视网膜脱离的增生性改变一般以后极部为主,发生在视盘、黄斑周围,形成星状固定皱褶,较少发展到远周边部。
3、玻璃体改变非外伤性黄斑裂孔视网膜脱离大部分并发不同程度的玻璃体后脱离。有时可见裂孔盖片附着其上。不完全的后脱离常存在玻璃体视网膜牵拉。由周边裂孔引起的视网膜脱离继发黄斑裂孔者,黄斑裂孔系由黄斑囊样变性演变而成,可称为继发性黄斑裂孔以与原发性黄斑裂孔相区别,因在手术治疗上两者有所不同。
并发症
检查
若黄斑区视网膜脱离程度不高,OCT检查可以清楚地显示裂孔及玻璃体的情况,包括玻璃体液化腔隙、玻璃体后皮质与视网膜之间的残余粘连、黄斑区神经上皮层缺失、视网膜神经上皮层与色素上皮层/脉络膜毛细血管层之间出现低反射区、视网膜内表面强反射光带(提示视网膜前膜的存在)等。
诊断
鉴别诊断
1、由于视网膜破裂时周围组织发生卷曲,真性裂孔都有一清晰的边界,即使极小的裂孔也是如此。
2、裂孔处组织缺损,裂隙光带在缺损处完全中断(Allen-Wazekesign)。
3、通过裂孔可以看到暗红色健康搜索的反光,脱离较低时可看到脉络膜的结构。囊样变性基础上发生的小穿孔及高度近视眼后极脉络膜萎缩区内的裂孔是最难以辨认的。
4、光学相干断层成像技术(OCT)检查可以准确诊断。
治疗
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。