胸主动脉夹层动脉瘤
临床表现
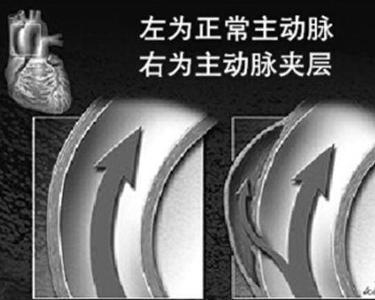
 绝大多数病人夹层主动脉瘤出现时突然感觉腹部、胸部或背部刀割样或撕裂样剧烈疼痛。胸痛可放射到颈、臂部,与急性心肌梗塞相类似。给予吗啡类药物亦未能减轻疼痛。疼痛为持续性,直到夹层动脉瘤穿破后才自行缓解。患者常呈现皮肤苍白、出汗、周围性紫绀等休克征象,但血压仍高于正常。腹部疼痛易与急腹症相混淆,但夹层动脉瘤病例很少呈现恶心、呕吐、腹部压痛和腹肌紧张。主动脉壁剥离病变累及升主动脉者可呈现主动脉瓣关闭不全的舒张期心脏杂音。累及锁骨下动脉、颈总动脉和髂股动脉者可出现局部血管杂音,同侧脉搏和血压减弱或消失。病变累及脑血管者易与高血压引致的脑出血或脑血栓形成相混淆。肋间动脉受累可突然出现截瘫。
绝大多数病人夹层主动脉瘤出现时突然感觉腹部、胸部或背部刀割样或撕裂样剧烈疼痛。胸痛可放射到颈、臂部,与急性心肌梗塞相类似。给予吗啡类药物亦未能减轻疼痛。疼痛为持续性,直到夹层动脉瘤穿破后才自行缓解。患者常呈现皮肤苍白、出汗、周围性紫绀等休克征象,但血压仍高于正常。腹部疼痛易与急腹症相混淆,但夹层动脉瘤病例很少呈现恶心、呕吐、腹部压痛和腹肌紧张。主动脉壁剥离病变累及升主动脉者可呈现主动脉瓣关闭不全的舒张期心脏杂音。累及锁骨下动脉、颈总动脉和髂股动脉者可出现局部血管杂音,同侧脉搏和血压减弱或消失。病变累及脑血管者易与高血压引致的脑出血或脑血栓形成相混淆。肋间动脉受累可突然出现截瘫。
病理改变
 动脉壁中层退行性病变,各层组织粘合力减退,主动脉壁受血流冲击或血管滋养管裂破引致内膜断裂,则主动脉壁中层剥离,形成外层薄、内层厚的壁间血肿。心脏搏动产生的应力对升主动脉和近段降主动脉影响最大,因而60~70%的病例夹层动脉瘤起源于升主动脉,25%起源于近段降主动脉。约90%的病例并有高血压。夹层动脉瘤形成后,可向远段主动脉延伸,累及胸主动脉全长和腹主动脉及其分支;向近段主动脉延伸则累及冠状动脉和主动脉瓣,引致冠循环血流阻断或主动脉瓣关闭不全。夹层病变累及颈总动脉则产生脑缺血症状;肋间动脉受累则可引致脊髓缺血产生截瘫;肾动脉受累则引致肾功能衰竭;髂、股动脉受累则可引致肢体坏死。夹层动脉瘤长大后如外层穿破入心包腔或胸膜腔,则产生心包压塞或大量血胸引致死亡。有的病人动脉瘤内层穿破入主动脉腔,则主动脉形成两个血流通道,主动脉壁剥离过程就不再发展,病情得到缓解。
动脉壁中层退行性病变,各层组织粘合力减退,主动脉壁受血流冲击或血管滋养管裂破引致内膜断裂,则主动脉壁中层剥离,形成外层薄、内层厚的壁间血肿。心脏搏动产生的应力对升主动脉和近段降主动脉影响最大,因而60~70%的病例夹层动脉瘤起源于升主动脉,25%起源于近段降主动脉。约90%的病例并有高血压。夹层动脉瘤形成后,可向远段主动脉延伸,累及胸主动脉全长和腹主动脉及其分支;向近段主动脉延伸则累及冠状动脉和主动脉瓣,引致冠循环血流阻断或主动脉瓣关闭不全。夹层病变累及颈总动脉则产生脑缺血症状;肋间动脉受累则可引致脊髓缺血产生截瘫;肾动脉受累则引致肾功能衰竭;髂、股动脉受累则可引致肢体坏死。夹层动脉瘤长大后如外层穿破入心包腔或胸膜腔,则产生心包压塞或大量血胸引致死亡。有的病人动脉瘤内层穿破入主动脉腔,则主动脉形成两个血流通道,主动脉壁剥离过程就不再发展,病情得到缓解。
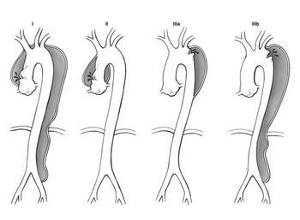
分型:1965年DeBakey按夹层动脉瘤发生的部位和范围分为三种类型,在临床上得到广泛应用。
I型:内膜破裂处位于升主动脉,主动脉壁剥离范围起源于升主动脉,累及主动脉弓、降主动脉,并可延伸到腹主动脉。
Ⅱ型:内膜破裂处位于升主动脉,主动脉壁剥离范围局限于升主动脉。
Ⅲ型:内膜破裂处位于左锁骨下动脉开口远端的近段降主动脉。主动脉壁向降主动脉方向剥离,可延伸到腹主动脉,但不涉及升主动脉壁。
Stanford分型则根据升主动脉是否受累分为A、B二种类型。
A型:内膜破裂处可位于升主动脉、主动脉弓或近段降主动脉。夹层动脉瘤的范围累及升主动脉,甚或主动脉弓、降主动脉和腹主动脉。Stanforda型相当于DeBakey分型的I型和Ⅱ型。A型约占病例数的66%。
B型:内膜破裂处常位于近段降主动脉,夹层动脉瘤的范围仅限于降主动脉或延伸入腹主动脉,但不累及升主动脉。相当于DeBakeyⅢ型。B型约占33%。
辅助检查
 心电图检查:心电图检查一般无异常征象,可排除心肌梗塞的诊断。并有高血压的病例可显示左心室肥厚。
心电图检查:心电图检查一般无异常征象,可排除心肌梗塞的诊断。并有高血压的病例可显示左心室肥厚。
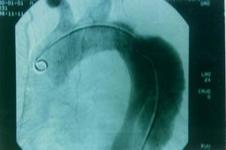
胸部X线检查:胸部X线检查是简便可靠的诊断方法。夹层主动脉动脉瘤累及升主动脉的病例,在胸部X线平片上显示纵隔阴影向右侧增宽,累及降主动脉者则向左侧增宽。主动脉弓呈局限性隆起,升主动脉与降主动脉外径悬殊,升主动脉与主动脉弓扩大、变形。主动脉壁增厚,致内膜钙化斑与主动脉外缘间距增宽。间隔半小时重复摄片,显示胸主动脉与纵隔形态发生改变。有时主动脉呈现双腔阴影。有的病例可显示胸膜腔积液。胸部X线检查显示上述异常者应立即作主动脉造影检查,要求充分显示主动脉全长(从主动脉瓣到腹主动脉分叉处)。主动脉造影可显示主动脉壁剥离形成的血流异常通道压迫主动脉腔,了解主动脉壁剥离段的长度、内膜裂破的部位、主动脉瓣的解剖及功能情况以及主动脉主要分支如颈总动脉、肾动脉受累情况等。夹层动脉瘤的主动脉造影阳性征象有:造影剂在主动脉内分为两个通道且形态不光整,造影剂未能进入主动脉主要分支以及主动脉瓣关闭不全。
治疗措施
主动脉夹层动脉瘤病情异常凶险,发生夹层动脉瘤后24小时生存率仅40%,1星期生存率为25%,3个月生存率仅10%。病变累及升主动脉者预后更差,1个月生存率仅8%,而病变仅累及胸降主动脉者则1个月生存率可达75%。高血压加速主动脉壁剥离过程,加剧疼痛并促使病人因夹层破裂引致血心包、血胸或纵隔积血而早期死亡,对病情起不良作用。因此拟诊为主动脉夹层动脉瘤的病例在未经主动脉造影确定诊断之前,即应进行治疗。给予药物降低血压,降低周围血管阻力和减少左心室收缩力,使主动脉壁剥离范围不再扩大。最常用的药物是阿方那特(Arfonad)或硝普钠。严密监测心电图、血压、中心静脉压、肺微嵌压、肺动脉压和尿量。调整药物剂量使血压维持在13.3~16.0kPa(100~120mmHg),尿量每小时至少30ml。
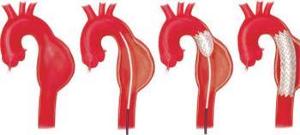
病情稳定后立即进行主动脉造影术,明确主动脉壁剥离病变的部位和范围。夹层动脉瘤病例主动脉壁组织脆弱,易破碎,手术操作难度大,死亡率高。主动脉壁剥离病变累及升主动脉的病例即Stanford分类属a型或DeBakey分类属I型和Ⅱ型病例应施行外科手术治疗。Stanford分类属B型或DeBakey分类属Ⅲ型的病例,大多数经内科治疗病情稳定,可继续内科治疗,但如呈现下列情况即应施行外科手术治疗。
手术操作
1.主动脉壁剥离病变累及升主动脉的病例亦即Stanforda型或DeBakeyI型及Ⅱ型病例 胸骨正中切口,切开心包,全身肝素化后于右心房内插入单根引血导管,动脉给血管需插入未被主动脉壁剥离病变累及的股总动脉。开始体外循环并将体温降至25℃左右,心包腔内注入冰生理盐水作心脏局部深降温。左心房放入减压导管。在靠近无名动脉起点处阻断升主动脉。于升主动脉壁作纵切口,切开主动脉腔,经左、右冠状动脉开口插管灌注冷心脏停搏液。窥察内膜裂破部位和主动脉壁剥离病变是否累及主动脉瓣窦。剥离病变涉及主动脉瓣窦而主动脉瓣启闭功能仍正常者,则在瓣窦上方切断升主动脉然后在主动脉瓣交界处于主动脉壁里、外各放置一小块涤纶垫片,用褥式缝线穿过主动脉壁,缝合固定交界。然后在升主动脉近、远段切端主动脉壁里、外各放置环状窄条织片,缝合加固主动脉壁,再连续缝合升主动脉近、远段切端,然后作升主动脉对端吻合术或在两个切端之间植入一段人造血管。内膜破裂部位涉及主动脉弓者,可部分切除主动脉弓,替换以人造血管,再用主动脉壁包绕人造血管,起加固和止血作用。
病变情况需切除主动脉瓣者,则在切除主动脉瓣及病变段升主动脉后,作主动脉瓣替换及人造血管植入术,或用带瓣人造血管,人工瓣膜端与主动脉瓣瓣环作缝合术,在人造血管上切开小窗与冠状动脉开口附近主动脉壁作吻合术,或在人造血管与冠状动脉之间作大隐静脉分流术以保证冠状动脉血流。人造血管的另端与升主动脉远段切端作对端吻合术。
2. 主动脉壁剥离病变仅累及降主动脉的病例亦即StanfordB型或DeBakeyⅢ型病例 大多数经内科药物治疗后病情稳定,无需外科手术治疗,病情发展需要手术治疗者则施行病变段胸降主动脉切除和人造血管植入术。按病变情况尽可能缩短切除主动脉段的长度。为避免阻断降主动脉引致脊髓和内脏缺血缺氧损害,可采用体表低温麻醉并用药物控制上半身血压;应用临时性外分流导管;左心转流术或股静脉股动脉转流术,阻断病变段近、远侧主动脉后,加压注入冷乳酸林格溶液,降低脊髓温度,亦可保护脊髓。
作左侧后剖胸切口,经第5或第6肋床进胸。于近段降主动脉或颈总动脉与左锁骨下动脉之间放置主动脉阻断钳,另于病变段远侧放置降主动脉阻断钳。纵向切开病变段降主动脉,观察主动脉后壁肋间动脉开口部位情况,尽可能保留肋间动脉开口处的部分主动脉后壁。切除病变段降主动脉后,用环状窄条织片加固近、远段主动脉壁内外侧切端,再用缝线连续缝合固定主动脉壁与织片,然后用长度、口径、形态合适的一段人造血管与近、远侧主动脉切端作对端吻合术。保留主动脉部份后壁与肋间动脉者,则需斜向修剪人造血管的一端。吻合完成后先放松降主动脉远侧血管钳,如吻合口有漏血处需添缝数针,再缓慢地放松和取除近段主动脉阻断钳。植入的人造血管用夹层动脉瘤壁包绕缝合,起加固和止血作用。
术后处理与一般心脏血管大手术相同,但应密切注意血压情况,防止出现血压升高。术后随诊复查应注意残余的动脉瘤假道是否增大,增大者应及时处理,以免发生破裂。手术治疗效果:夹层动脉瘤的手术死亡率仍较高。病变累及升主动脉的病例,手术死亡率为20~40%,病变仅限于降主动脉者,手术死亡率为25~60%。主要死亡原因有主动脉或吻合口破裂出血、急性心力衰竭、脑血管病变、肠系膜或肾血管梗塞和肺部并发症。术后约10~20%的病例并发截瘫。术后5年生存率约为50%,术后10年、20年生存率降至30%和5%。
并发症
当DeBekayI、II型夹层剥离累及主动脉瓣时,出现主动脉瓣区的舒张期或收缩期杂音,主动脉瓣关闭不全时极易发生急性左心衰竭,出现心率快,呼吸困难等。夹层剥离累及冠状动脉时可引起急性心肌缺血或心肌梗死,夹层剥离破入心包时可迅速发生心包填塞,导致猝死。当发病数小时后可出现周围动脉阻塞现象,可出现颈动脉或肢体动脉搏动强弱不等,严重者可发生肢体缺血坏死。夹层累及主动脉弓部头臂动脉,可引起脑供血不足,甚至于昏迷、偏瘫等。降主动脉的夹层累及肋间动脉可影响脊髓供血引起截瘫。累及腹腔脏器分支则可引起肝供血不足,肝功受损,类急腹症表现或消化道出血、肾功损害和肾性高血压等。
预防说明
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。