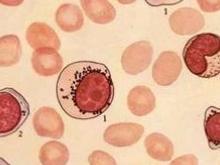
小儿骨髓增生异常综合征
流行病学
block等于1953年注意到小儿骨髓增生异常综合征易发展为白血病,提出“白血病前期”的命名。1976年法美英协作组(fab)。考虑到这术语不够恰当,因为部分患者在未成为白血病之前可死于出血或感染,,并非全部发展为白血病,故推荐应用骨髓增生异常综合征(mds)的命名。
小儿骨髓增生异常综合征可为原发性,也可继发于肿瘤长期化疗和放疗之后,称为继发性。常在疾病过程中可转化为白血病。本病多见于老年,但近年发现儿童患者也并非很少见,且儿童mds的某些特点与成人有所不同。某些遗传性疾病如范可尼贫血、bloom综合征、21-三体等,以及某些骨髓增殖性疾病患者为小儿骨髓增生异常综合征的高发人群。
1982年fab将小儿骨髓增生异常综合征分为5种亚型,对本组疾病的3种血细胞形态异常做了详细描述,称之为“病态造血”,正式命名本组疾病为mds。1987年更提出用形态学、免疫学和细胞遗传学的方法进行分类(mic分类),进一步提高了诊断与分类的精确性。
德国düsseldorf医院内科1975~1988年共检查骨髓涂片15074例,有41例诊断为mds,占2.9%,患者中位年龄72岁,证实本病在老年常见。丹麦odense市调查了儿童mds的发病率,发现在近262万人年中有9例mds,年龄0~14岁,其中2例合并down综合征,除此2例,年发病率为0.27/10万。mds占同期恶性血液病的8.7%。
我国杨崇礼等调查了天津某医院11年间收治的1917例血液病,其中mds 37例,占1.93%。还调查了天津1986~1988年mds发病率,在近145万人口中,3年发生mds 10例,年发病率为0.23/10万;同期同人群中白血病发病率为3.36/10万,再生障碍性贫血为0.92/10万,恶性组织细胞增生症为0.07/10万,多发性骨髓瘤为0.16/10万,表明mds远少于白血病和再生障碍性贫血,但多于恶性组织细胞增生症和多发性骨髓瘤。
发病机制
mds存在原癌基因突变、骨髓体外培养异常以及细胞遗传学变异均提示本病属克隆性疾患。通过对ras女性患者的葡萄糖-6-磷酸脱氢酶(g-6-pd)同工酶检查,发现其红细胞、粒细胞、血小板、巨噬细胞及b、t淋巴细胞只有a型同工酶,从而证实本病的克隆性。中国医学科学院血液学研究所蒋其波检查了51例mds染色体,25例有异常核型,其中6例为同样的异常核型,也提示mds为克隆性病变。通过原位杂交法检查11例7单体(-7)mds患者,发现t、b淋巴细胞只有1.9%为-7阳性,证实此11例mds病变始于髓系干细胞而非多能干细胞。从建立细胞系分析原来mds病变水平的方法,又发现部分mds的病变发生于能分化为髓系及b淋巴细胞系的祖细胞。在白血病前期,癌细胞克隆已经建立并表达为部分有效造血。baskind认为,mds的发病至少有两个步骤,先为某种因素使遗传型不稳定的多能干细胞克隆性增生,其后另一因素使其子代发生染色体异常。可能需要多步骤才能成为失去控制的恶性增生。
牵涉到生长调节基因(如ras,fms)的体细胞突变多处于继发髓系白血病发病的早期。ras突变率因mds的类型而异,以cmml的突变率最高。有ras突变者最易发展为aml。低于正常的克隆性生长以及造血前体细胞的损伤性突变可随mds至aml的演变而进一步恶化。体外试验表现为集簇与集落的比率增加,所有造血前体细胞的克隆形成能力减低或缺乏。应用gm-csf或g-csf来刺激gm-cfu,有72%~89%mds病人表现异常。
mds伴有贫血的病人可见促红细胞生成素增加,但体外试验红系的克隆生长以及对促红素的反应不良。体外生长类型的改变以及出现其他非整倍体克隆可能预示白血病的转化。上述研究还提示,集落刺激因子反应性减低和骨髓内有效含量的可利用性减低可能是mds病人某些细胞减少的原因。
mds病人约有45%发生核型异常,以raeb和raei-t亚型居多,按频率多少依次为7单体、5q、8-三体、-y、1异常、7q、17异常、12p和20异常是主要的核型缺陷。如出现复杂异常和7单体提示白血病的发生率高。核型畸变多见于mds的晚期。
有关mds与白血病的关系,多数认为mds如不死于血细胞减少所致合并症,都将发展为白血病。医科院血液学研究所观察的54例mds,87%向白血病演变。koefller等观察了液体培养中的mds骨髓细胞,发现它们确能缓慢成熟。也观察了大量分裂期的细胞核型,几乎都带有原来恶性克隆的标志,表明即使在mds时白血病的恶性克隆已经建立,且比正常生长占优势,但仍能部分地有效造血,随着恶性克隆的成熟障碍逐渐加重,最后完全不能成熟,遂发展为白血病。儿童mds有40%~45%的raeb和raep-t转化为白血病,但ra和ras转化为白血病仅见于5%~15%。oertel通过对cd34细胞的研究发现,随着mds的进展,cd34细胞阳性率逐渐升高。siitonen研究了c-kit原癌基因mrna在mds患者中的表达情况,发现ra组(0.377)、raeb/raeb-t组(1.060)明显高于正常对照组(0.193),由此认为c-kit在mds的高表达可能预示向aml进展。
发病原因
小儿骨髓增生异常综合征的病因未明,但多种因素如病人的敏感性、年龄、性别、发病前接触致白血病物质和感染等均可能导致mds。
1.分型 1982年,fab协作组确定了mds的名称,将此综合征分为5型。结合国内实践,在1994年成都全国小儿白血病和恶性淋巴瘤研讨会上,对mds作具体分型如下:
(1)难治性贫血(ra):骨髓中原始+早幼粒细胞(下称原+早)<5%,血中原+早<1%。
(2)难治性贫血伴环状铁粒幼红细胞(rars):骨髓及血象似ra,但骨髓中出现环状铁粒幼红细胞>15%。
(3)难治性贫血伴原始细胞增多(raeb):骨髓中原+早5%~20%,血中原+早<5%。
(4)难治性贫血伴原始细胞增多在转变中(raeb-t):符合下述任一项即可诊断:①血中原+早>5%;②骨髓中原+早20%~30%;③不成熟细胞中出现auer小体。
(5)慢性粒单细胞白血病(cmml):骨髓象及血象似raeb,但血中单核细胞≥1.0×10/l,在儿科现称之为幼年型粒-单白血病(jmml)。
2.染色体异常 1994年国际幼年型粒-单核细胞白血病工作组制订的jcml最低诊断标准则为:
(1)白细胞计数>13×10/l。
(2)单核细胞绝对值>1×10/l。
 (3)外周血有不成熟粒细胞(原始、早幼、中幼)。
(3)外周血有不成熟粒细胞(原始、早幼、中幼)。
(5)除外t(9;22)(q34;21)或bcr/abl重排。
-7是儿童mds最常见的,通常也是惟一的染色体异常。原发性儿童mds有-7者占40%,伴发先天或遗传异常的儿童mds常出现-7。imo7s特指发生在4岁以下婴幼儿的-7综合征。男性多见,男女比为4.7∶1。外周血白细胞和单核细胞增多,贫血,血小板减少,常见幼稚红细胞及幼稚粒细胞,骨髓呈骨髓增殖性疾病特征。患儿经常发生感染,肝、脾、淋巴结肿大,多很快转化为aml。
临床表现
儿童mds可见于婴儿到青春期的任何年龄段。据有关资料显示,最小为5个月,最大13岁。男孩发病稍多于女孩。其症状主要表现为贫血、出血、发热、感染和肝脾肿大。患者绝大多数都有贫血,但程度较轻,主要为红细胞无效性生成所致。出血的发生率为23%~95%,多为较轻的皮肤、黏膜出血。病情进展至晚期可有严重出血,甚至发生脑出血而死亡。发热和感染的发生率各家报告不一,多为50%~60%,多随病情的进展而增高,感染的原因为中性粒细胞减少和功能改变以及机体免疫能力下降所致。有10%~76%可见肝、脾、淋巴结肿大,但少见于ra亚型。肝大较脾大多见。有淋巴结肿大者较少。总之,mds的临床表现差别很大,一般ra和ras症状较轻,随病情的演进而逐渐增重。
检查
1.血液检查
(1)血象90%以上有贫血,50%全血细胞减少。血红蛋白F可增高。血小板轻度减低,偶见升高。多数患儿白细胞计数小于5×109/L,有半数病人中性粒细胞绝对值小于2×109/L。白细胞减少者多有淋巴细胞比例增高。
(2)血涂片红细胞为大细胞或正细胞性,红细胞体积偏大,MCV常>95/fl。细胞大小不等,偶见巨大红细胞。可见异形红细胞、点彩细胞、HJ小体和有核红细胞,常有Pelger-Hut白细胞异常和环形核细胞,胞浆内特异性颗粒减少或缺如。可见幼稚粒细胞和脱颗粒。血涂片上血小板大小不均,偶见巨大血小板,有的患者血小板松散存在,不能聚集成簇。个别患者血涂片出现淋巴样小巨核细胞或单圆核小巨核细胞。
2.骨髓检查
(1)骨髓象骨髓增生活跃,红细胞系巨幼变明显,呈“老浆幼核”、多核化、核碎裂及核形态怪异,双核尤以奇数核红细胞和巨大红细胞具特征性。粒系成熟停滞,核浆发育不平衡和双核粒细胞常见。RA及RAS红系统多增生亢进,粒系统相对减少,粒/红减低或倒置,但中幼粒增多。在RAEB-T时可能粒系统增多,红系统减少。各阶段粒细胞均可见双核者,双核细胞胞体比正常大约一倍,对MDS诊断有特征性意义。单核细胞增多。巨核细胞数量多数增多或正常,约1/4患者巨核细胞减少。可见形态奇异的淋巴样小巨核细胞、单圆核小巨核细胞、多圆核巨核细胞、大单圆核巨核细胞、双核巨核细胞或多分叶巨核细胞。其中以淋巴样小巨核细胞最有特征性意义。
(2)骨髓活检可见粒系不成熟前期细胞异常定位(AL-IP)。多见于原始细胞过多性难治性贫血(RAEB),转化型原始细胞过多性难治性贫血(RAEB-T)及慢性骨髓单核细胞白血病(CMML)。ALIP阳性者存活期短。骨髓涂片有时亦可见ALIP现象。
(3)骨髓组织化学染色中性粒细胞的过氧化酶、碱性磷酸酶均减低,单核细胞非特异脂酶、酸性磷酸酶减低,铁粒幼红细胞增加。
3.染色体检查
50%患者有染色体异常,如-7、+8和5q-等,核型异常者转化为白血病可能性大。儿童染色体改变主要为单体7,其次为占有较小比例的三体8和3号染色体的改变。
4.祖细胞培养
骨髓祖细胞体外培养,部分类似白血病细胞生长,CFU-GM、CFU-MK和CFU-E等集落形成低或缺如。小丛型、无生长型和丛落比明显升高型均为白血病前期生长型,提示预后不良。
(1)多向祖细胞(CFU-MIX)多表现为生长不良,提示MDS病变从多能干细胞开始。
(2)粒—单祖细胞(CFU-GM)多数为集落减少,集簇增加,集簇与集落比增加。
(3)红系祖细胞(CFU-E和BFU-E)多认为CFU-E与BFU-E均生成减少,培养中去除T细胞后,BFU-E并未增加:说明MDS红系祖细胞的减少并非由于T细胞的抑制作用所致。
(4)巨核祖细胞(CFU-MK)生长情况与FAB分型有一定关系。RA、RAS的CFU-MK生长较好,约半数集落正常,RAEB、RAEBT和CMML多数集落减少或不生长。
5.其他
诊断
根据临床表现和除其他有病态造血表现的疾病,实验室检查外周血任一系或任二系或全血细胞减少,偶可白细胞增多,可见有核红细胞或巨大红细胞或其他病态造血现象,骨髓有三系或两系或任一系血细胞呈病态造血可诊断。
2003年Hasle等参照成人MDS的WHO诊断分型标准提出了一个儿童MDS的WHO分型标准,并提出了儿童MDS的最低诊断标准,认为至少符合以下四项中的任何两项方可诊断为MDS:
1.持续性不能解释的血细胞减少(中性粒细胞减少、血小板减少或贫血)。
4.原始细胞增高(≥5%)。
鉴别诊断
需与以下疾病相鉴别:
是一种由于多种原因引起的骨髓造血功能代偿不全,在小儿时期比较多见,主要症状是贫血、出血和反复感染。临床上出现全血细胞减少而肝、脾、淋巴结不肿大的一组综合病征。核型检查有助于两者的鉴别。
2.巨幼细胞贫血
系脱氧核糖核酸(DNA)合成的生物化学障碍及DNA复制速度减缓所致的疾病。影响到骨髓造血细胞--红细胞系、粒细胞系及巨核细胞系而形成贫血,甚至全血细胞减少。骨髓造血细胞的特点是胞核与胞质的发育及成熟不同步,前者较后者迟缓,其结果形成了形态、质和量以及功能均异常的细胞,即细胞的巨幼变。MDS骨髓红系统有时有巨幼样变,故易与巨幼红细胞贫血相混淆,但MDS时血中叶酸、维生素B12多增加,而巨幼细胞贫血血中叶酸或维生素B12多减少。MDS用叶酸或维生素B12治疗多无效,而巨幼红细胞贫血疗效显著。
是由多种病因引起红细胞破坏加速,而骨髓造血功能代偿不足时发生的一类贫血。正常红细胞的寿命为110~120天。正常情况下,每天约有1%的衰老红细胞在脾脏中被吞噬和破坏,由新生的红细胞补充代替之,从而维持红细胞数量的恒定,以发挥正常的生理功能。MDS的RA骨髓红系统增多,有时病态造血现象十分显著,血中网织红细胞稍增加,此与溶血性贫血十分相似。MDS可有染色体核型的异常,而溶血性贫血多无之。此外,溶血性贫血可有相应病因的发现,如Coombs试验阳性、Ham试验阳性等,而在MDS多为阴性。MDS在治疗后网织红细胞先上升,然后血红蛋白上升,而溶血性贫血在治疗后网织红细胞先下降,然后血红蛋白上升
由于血小板大量减少引起皮肤、黏膜出现瘀点、溢血、鼻衄、牙龈出血和月经过多,小孩和年轻人多见,男女比例为1∶2。MDS骨髓的巨核细胞多增加(小巨核),ITP巨核细胞也增加,故有时两者相混,但依靠临床治疗时是否对泼尼松有效,骨髓象有否显著病态造血,染色体有否异常可将两病区别开来。
如慢性粒细胞白血病、真性红细胞增多症、原发性血小板增多症及骨髓纤维化等,骨髓均有病态造血现象,在诊断MDS时均须除外。有的患者有非造血组织的恶性肿瘤,当肿瘤未显露之前,先发生贫血,骨髓中也可表现某些病态造血现象,但不及MDS的病态造血显著。
并发症
如泌尿道、消化道、呼吸道和中枢神经出血,尤其颅内出血常危及小儿生命;若反复输血可致含铁血黄素沉着症。
2.感染
常并发感染,轻者可以有持续发热、体重下降、食欲不振、反复发生口腔黏膜溃疡、坏死性口炎及咽峡炎,可并发败血症,感染多加重出血而导致死亡。
3.其他
治疗
在治疗上尚无特效的方法。鉴于各亚型间是一种疾病的不同发展阶段,治疗应根据不同的病期而异。一般应遵循按阶段施治的原则。
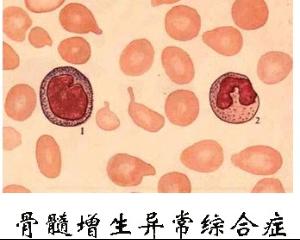
RA和RARS采用调节造血的药物为主,可按慢性再障治疗或给予诱导分化,如雄激素、肾上腺皮质激素、维A酸、干扰素等。如病情向白血病进展,可采用单药或联合化疗,如RA和RAS主要问题是贫血,多采用以调节和刺激造血的药物为主,类似于再生障碍性贫血的治疗。
RAEB治疗如同急性白血病。异基因骨髓移植是治愈此症的惟一途径,使用造血生长因子如莫拉司亭(GM-CSF)或非格司亭(G-CSF)、白介素-3、促红细胞生成素(EPO)等可使部分患者获得缓解。
RAER、RAEB-T和CMML可选用诱导分化、化疗或骨髓移植。
1.刺激造血
可选用司坦唑醇、糖皮质激素、重组白细胞介素3、雄激素及同化激素、集落刺激因子等。
2.诱导分化
可选用顺式或全反式维甲酸、干扰素α、靛玉红、三尖杉碱、维生素D3等或联合用药联合用药。
3.化疗
可选用小剂量阿糖胞苷、阿柔比星、伊达比星、依托泊苷、小剂量三尖杉碱、足叶乙甙及联合化疗。
4.骨髓移植
异基因骨髓移植为治疗MDS的最有效途径,儿童异基因骨髓移植疗效明显优于成人患者。对于配合相合的骨髓移植,约有50%~80%的病儿得到较长期的缓解。但由于骨髓来源等问题尚未能完全解决,故国内尚少应用。脐血及胎盘血干细胞移植,将代替骨髓移植。继发于癌症治疗后的MDS患者,建议在RAEB或RAEB-T早期进行移植为好。7号染色单体或复杂染色体核型异常的RC患儿,如有HLA匹配的同胞供体或无关供体,应在确诊后尽早进行SCT,其他RC患儿如有HLA匹配的同胞供体也应在确诊后尽早进行SCT。晚期MDS(RAEB和RAEB-t)应在确诊后尽早进行HLA完全匹配的同胞供体和无关供体或1个位点不合的无关供体SCT,如果疾病进展可考虑单倍体SCT。
预后
儿童MDS进展较快,可从RAEB很快转化为RAEBT乃至白血病,且预后差,部分患儿死于感染与贫血。儿童MDS的预后与多种因素有关,对于所有儿童MDS,性别与年龄无预后意义,但CMML则年龄越小预后越好,小于2岁者生存期明显长于2岁以上者。初诊时血小板计数、血液HbF含量以及细胞遗传学改变明显者影响儿童MDS预后。MDS的FAB分型即RA、RAS、RAEB及RAEB-t是疾病的阶段而非独立的型,如有的RA演变为RAEB,再演变为RAEB-t,再演变为白血病;有的在RA或RAEB时死于出血或感染。MDS的演变除少数为淋巴细胞性白血病外,多演变为粒细胞性白血病,以M1~M6均可见,其中以M1、M2最为多见。因类型不同,治疗措施较多,所以疗效不佳,综合性治疗可能改善预后。
预防
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。